Рекомендации по терапии оа коленных суставов esceo 2016
Согласно последним рекомендациям ESCEO по лечению остеоартрита таковое предполагает применение нефармакологических, фармакологических, а при необходимости хирургических методов. Фармакологическая терапия в свою очередь подразделяется на симптоматическую и структурно-модифицирующую. К симптоматическим препаратам (быстрого действия) относятся анальгетики, опиоиды, нестероидные противовоспалительные препараты. В статье приведены результаты исследований, свидетельствующие, что препарат Нимесил обладает быстро развивающимся клиническим эффектом, высоким профилем безопасности и может быть рекомендован для симптоматического лечения остеоартрита коленного сустава.

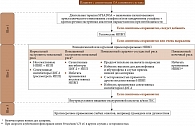
Алгоритм ведения больных ОА коленного сустава (ESCEO 2016)
В структуре всех патологий сустава 80% приходится на остеоартрит (ОА). Остеоартрит – хроническое гетерогенное прогрессирующее заболевание, характеризующееся деградацией экстрацеллюлярного матрикса хряща с последующим ремоделированием тканей сустава. Основные симптомы патологии – болевой синдром и краевые остеофиты.
У пациентов с ОА нарушается функциональная активность суставов и, как следствие, снижается качество жизни.
К факторам риска развития ОА относятся женский пол, дефицит эстрогенов в период постменопаузы, врожденные заболевания костей и суставов, избыточная масса тела, повышенная физическая нагрузка, травмы суставов и др. [1].
Остеоартрит чаще поражает коленные суставы.
Остеоартрит коленного сустава в большей степени распространен среди лиц старше 50 лет.
На сегодняшний день данным заболеванием страдают более 250 млн человек. В связи со старением населения к 2020 г. ОА может стать четвертой по значимости причиной инвалидизации [1].
Вследствие воздействия различных этиологических факторов нарушается обмен и синтетическая активность хондроцитов, а также происходит физико-химическое повреждение матрикса суставного хряща.
В основе нарушения метаболизма хряща при ОА лежит нарушение обмена протеогликанов – основного вещества хряща. Характерным признаком деструкции хряща является потеря матриксом гликозаминогликанов: хондроитинсульфата, кератансульфата, гиалуроновой кислоты. В результате происходит дегидратация хряща, дезорганизация и разрыв коллагеновых волокон. Определенная роль в патогенезе ОА отводится воспалению. Механизм, посредством которого воспаление может участвовать в деградации хряща, – выработка провоспалительных цитокинов (интерлейкинов 1-бета и 6, фактора некроза опухоли альфа и др.). Они в свою очередь способствуют высвобождению ферментов, повреждающих коллаген. Речь, в частности, идет о коллагеназе, эластазе, пептидазе [2].
Лечение должно быть направлено на снижение выраженности симптомов и замедление прогрессирования патологии. Это позволит уменьшить негативное влияние ОА на функциональную активность сустава и качество жизни пациентов, в долгосрочной перспективе – потребность в аналгезии и эндопротезировании.
Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO) в 2014 г. опубликовало рекомендации по лечению ОА коленного сустава, в которых определена приоритетность разных терапевтических вмешательств. Эксперты исходили из эффективности (уменьшение выраженности боли, улучшение функции сустава), безопасности (сокращение риска развития нежелательных явлений), структурно-модифицирующего действия, фармакоэкономики методов лечения.
Появление новых данных стало основанием для обновления рекомендаций. И в 2016 г. ESCEO предложило алгоритм, максимально приближенный к клинической практике (рисунок) [2]. Согласно современным рекомендациям лечение ОА предполагает применение нефармакологических, фармакологических, при необходимости хирургических методов. К важнейшим нефармакологическим методам терапии относятся снижение массы тела и укрепление мышц. Среди фармакологических методов лечения основное место занимают симптоматические (анальгетики, опиоиды, нестероидные противовоспалительные препараты (НПВП)) и структурно-модифицирующие препараты (Symptomatic Slow-Acting Drug in Osteoarthritis – SYSADOA). Первые относятся к средствам быстрого действия, вторые – отсроченного. Их совместное применение обеспечивает эффективность лечения.
На сегодняшний день алгоритм ведения пациентов с ОА состоит из четырех шагов.
Шаг 1. Применение нефармакологических методов.
К немедикаментозным методам относятся физиотерапия, мануальная терапия, бальнеотерапия и физическая активность (например, прогулки).
Однако согласно выводам экспертов ESCEO при оказании первичной медицинской помощи для купирования боли при легком или умеренном ОА следует использовать парацетамол до 3 г/сут.
Применение парацетамола свыше указанной дозы ассоциируется с высоким риском госпитализаций по поводу язвенного дефекта, перфорации или кровотечения в желудочно-кишечном тракте (относительный риск (ОР) 1,20 при 95%-ном доверительном интервале (ДИ) 1,03–1,40).
Длительный прием высоких доз препарата приводит к поражению почек у женщин (OР 2,04 (95% ДИ 1,28–3,24)) – скорость клубочковой фильтрации снижается более чем на 30 мл/мин/1,73 м2, повышению риска развития артериальной гипертензии и у женщин (ОР 2,00 (95% ДИ 1,52–2,62)), и у мужчин (ОР 1,34 (95% ДИ 1,00–1,79)).
Не случайно уже на этом этапе лечения эксперты ESCEO рекомендуют терапию структурно-модифицирующими препаратами с добавлением при необходимости парацетамола для краткосрочного купирования боли. Среди лекарственных средств указанной группы наибольшая доказательная база собрана в отношении глюкозамина сульфата и хондроитина сульфата. Глюкозамина сульфат оказался эффективнее плацебо не только в снижении выраженности боли (стандартизованное среднее различие (ССР) 1,11 (95% ДИ -1,66– -0,57)), но и в улучшении функции суставов (оценивали по индексу Лекена) (ССР -0,47 (95% ДИ -0,82– -0,12)) [3–5].
Систематические обзоры свидетельствуют, что препараты хондроитина сульфата могут оказывать влияние на структурные изменения сустава, их эффективность в отношении симптомов заболевания сопоставима с эффективностью глюкозамина сульфата [4–8]. В исследовании, проведенном М. Hochberq (2014), установлено, что комбинация хондроитина сульфата и глюкозамина сульфата не уступает по силе действия целекоксибу после 180 дней терапии [7].
Таким образом, глюкозамина сульфат и хондроитина сульфат можно рассматривать как средства, обеспечивающие долгосрочный симптом-модифицирующий эффект при ОА, защиту суставного хряща и замедление прогрессирования заболевания [8, 9]. Кроме того, частота нежелательных явлений на фоне такой терапии сопоставима с частотой побочных эффектов при приеме плацебо.
Если на фоне адекватной базисной терапии SYSADOAs (с доказанной эффективностью) и применения парацетамола в качестве экстренной аналгезии симптомы ОА сохраняются, в схему лечения могут быть добавлены топические НПВП или капсаицин. Результаты прямых сравнительных исследований свидетельствуют, что топические НПВП столь же эффективны, что и системные (пероральные) НПВП. Обобщенный эффект в отношении снижения боли при наружном применении НПВП оценен в 0,44 (95% ДИ 0,27–0,62), хотя в отношении указанного показателя между разными препаратами наблюдается значительная гетерогенность (I2 – 69%).
Из-за более низкой системной абсорбции и, как следствие, лучшей переносимости топические НПВП могут иметь предпочтение перед системными (пероральными) НПВП. Это особенно важно для пациентов с ОА 75 лет и старше, лиц с сопутствующими заболеваниями или повышенным риском развития гастроинтестинальных, сердечно-сосудистых или почечных побочных реакций.
Терапия топическими НПВП характеризуется более низким риском развития нежелательных явлений со стороны желудочно-кишечного тракта. В то же время она ассоциируется с повышением частоты легких кожных реакций.
Шаг 2. Использование системных НПВП.
Пероральные НПВП традиционно занимают лидирующие позиции в фармакологическом лечении ОА. Они оказывают умеренное влияние на боль – от 0,29 (95% ДИ 0,22–0,35), что превышает таковое парацетамола – 0,14. Однако прием пероральных НПВП ассоциируется с трех- – пятикратным увеличением риска осложнений со стороны верхних отделов желудочно-кишечного тракта, в том числе перфорации пептической язвы, обструкции и кровотечения. В то же время разные НПВП существенно различаются по частоте гастроинтестинальных и сердечно-сосудистых нежелательных явлений. Экспертная группа ESCEO пациентам с низким (нормальным) гастроинтестинальным риском рекомендует назначать либо неселективные НПВП с/без ингибиторов протонной помпы (ИПП), либо селективные ингибиторы циклооксигеназы (ЦОГ) 2.
Необходимо отметить, что повышение риска осложнений со стороны верхних отделов желудочно-кишечного тракта обусловлено такими факторами, как пожилой возраст, пептическая язва в анамнезе, сопутствующее лечение глюкокортикостероидами (ГКС), аспирином или антикоагулянтами.
В реальной клинической практике выбор перорального НПВП основывается на оптимальном соотношении эффективности, безопасности и стоимости. Одним из препаратов, обладающих таким оптимальным соотношением, является нимесулид (Нимесил) [9–15].
Молекула нимесулида в отличие от молекул других препаратов группы НПВП имеет свойства основания. Это затрудняет ее проникновение в слизистую верхних отделов желудочно-кишечного тракта, как следствие, уменьшается возможность контактного раздражения.
Благодаря высокой биодоступности уже через 30 минут после приема концентрация препарата в крови составляет 50% от пиковой и отмечается выраженный обезболивающий эффект. Максимальная концентрация в плазме крови достигается в среднем через два-три часа, соответственно к этому времени развивается и максимальное анальгетическое действие [12].
Нимесулиду свойственны эффекты, не связанные с класс-специфическим влиянием на синтез простагландинов и определяющие его терапевтическое своеобразие: подавление синтеза провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли альфа), активности металлопротеиназ, ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при ОА, блокирование фосфодиэстеразы 4, повышающей активность клеток воспалительной агрессии – макрофагов и нейтрофилов, а также антигистаминное действие.
Рандомизированные клинические исследования подтверждают мощный и быстрый анальгетический и противовоспалительный эффекты нимесулида. Это определяет целесообразность использования нимесулида (Нимесила) при ОА. Так, терапия нимесулидом у больных ОА коленного и тазобедренного суставов способствовала снижению концентрации маркеров катаболизма хрящевой ткани [13, 14].
Кроме того, отмечено положительное влияние нимесулида на динамику артериального давления (оценивалось по данным суточного мониторирования) у пациентов с артериальной гипертензией. Через 30 дней наблюдения у получавших нимесулид в отличие от принимавших диклофенак не зафиксировано дестабилизации артериального давления. Так, на фоне нимесулида среднее систолическое артериальное давление снизилось с 143 до 140 мм рт. ст., диклофенака – повысилось с 147 до 156 мм рт. ст. (p
Принципиальное значение для оценки безопасности препарата имеют результаты его длительного применения. Так, в работе P. Locker и соавт. 199 пациентов с ОА получали нимесулид 200 мг или этодолак 600 мг в течение трех месяцев. Терапевтический потенциал нимесулида оказался выше: его действие оценили как хорошее или превосходное 80% больных. Этодолаку аналогичную оценку дали 68% пациентов. Несмотря на то что этодолак относится к селективным НПВП, частота побочных эффектов в группах терапии не различалась [14].
На данный момент проведено недостаточно серьезных эпидемиологических исследований, в которых сравнивалась бы гепатотоксичность НПВП. Наиболее значимое среди них – масштабное популяционное исследование, проведенное G. Traversa и соавт. Ученые проанализировали частоту гепатотоксических реакций с 1997 по 2001 г. у 397 537 больных. Суммарное число таких осложнений составило 29,8 на 100 тыс. пациенто-лет. Следовательно, ОР тяжелых гепатотоксических реакций для НПВП составляет 1,4. Для сравнения – частота осложнений со стороны печени при использовании нимесулида составила 35,3 на 100 тыс. пациенто-лет. Это оказалось ниже, чем у диклофенака – 39,2 на 100 тыс. пациенто-лет, кеторолака – 66,8 и ибупрофена – 44,6 [15, 16].
В ретроспективном исследовании, проведенном в Научно-исследовательском институте ревматологии им. В.А. Насоновой, у 322 больных, принимавших нимесулид не менее 12 месяцев, не было отмечено эпизодов клинически выраженной патологии печени: желтухи, гепатомегалии, симптомов печеночной недостаточности. Существенное – более чем двукратное по сравнению с нормальным уровнем – повышение печеночных ферментов зафиксировано лишь у семи (2,2%) больных ревматоидным артритом. Необходимо отметить, что эти пациенты помимо нимесулида получали цитотоксические препараты (метотрексат или лефлуномид) [17, 18].
Исходя из вышесказанного, можно сделать вывод: Нимесил – универсальное средство для лечения ОА, в котором сочетаются быстрота действия, хороший анальгетический и значимый противовоспалительный эффекты. По переносимости Нимесил превосходит многие традиционные НПВП. Препарат относительно редко вызывает диспепсию и другие осложнения со стороны желудочно-кишечного тракта.
Избегать применения пероральных НПВП экспертная группа ESCEO рекомендует пациентам с повышенным риском развития нежелательных явлений со стороны почек, например с хронической болезнью почек и скоростью клубочковой фильтрации ниже 30 мл/мин/1,73 м2.
Из соображений безопасности и в отсутствие долгосрочных исследований рекомендуется использовать пероральные НПВП эпизодически или курсами, в минимальной эффективной дозе и в течение как можно более короткого времени, необходимого для контроля над симптомами.
При противопоказаниях к НПВП или сохранении симптомов, несмотря на проводимое лечение, следует рассмотреть возможность внутрисуставного введения препаратов гиалуроновой кислоты или ГКС.
Экспертная группа ESCEO указывает, что гиалуроновую кислоту необходимо назначать пациентам с ОА коленного сустава легкой или умеренной степени тяжести, а также лицам с более тяжелым заболеванием, которым противопоказано тотальное эндопротезирование коленного сустава или которые хотят отсрочить операцию. Препараты гиалуроновой кислоты для интраартикулярного введения показаны в отсутствие признаков острого воспаления. При наличии таковых в качестве терапии первой линии внутрь сустава следует вводить ГКС. Одновременное интраартикулярное введение гиалуроновой кислоты и ГКС не рекомендуется из-за риска межлекарственного взаимодействия. Таковое станет возможным, когда будет доказана их фармацевтическая совместимость.
Шаг 3. Предоперационная терапия.
Пациентам, ожидающим операцию, рекомендуется краткосрочное применение опиоидных препаратов (например, трамадола) и антидепрессантов.
Слабые опиоиды назначаются при тяжелых симптомах ОА.
В отличие от обычных опиатов трамадол редко вызывает угнетение дыхания и зависимость. Кроме того, его использование не ассоциируется с повышением риска гастроинтестинальных и сердечно-сосудистых осложнений, характерных для НПВП.
Наиболее частые побочные эффекты терапии трамадолом – тошнота и головная боль. В некоторых случаях они могут стать причиной прекращения лечения либо недостаточного обезболивания.
Риск побочных реакций может быть снижен благодаря медленной титрации дозы и приему трамадола медленного высвобождения (от 50 до 100 мг/сут в течение семи дней).
По мнению экспертов ESCEO, кратковременное применение трамадола может быть показано пациентам с очень выраженными симптомами ОА.
Антидепрессанты, в том числе дулоксетин, используют при хроническом болевом синдроме. Они обладают центральным механизмом действия, влияя на болевые нейромедиаторы (серотонин и норадреналин). Однако доказательства эффективности антидепрессантов при ОА ограничены, а частота нежелательных явлений достаточно высока.
Шаг 4. Замена сустава и другие хирургические процедуры.
В качестве альтернативы хирургическому вмешательству на этом этапе предлагается назначать опиоидные анальгетики для перорального или трансдермального введения.
В рекомендациях ESCEO за 2016 г. рассмотрены все современные методы лечения ОА, которые включены в алгоритм ведения больных. Исследовательская группа ESCEO полагает, что представленная мультимодальная программа должна применяться у всех больных.
Когда пациент переходит ко второму шагу – терапии пероральными НПВП, лечение, предусмотренное на первом шаге, должно продолжаться, так как оно по-прежнему влияет на течение заболевания.
Аналогичным образом решение о необходимости внутрисуставного введения гиалуроновой кислоты и ГКС (при сохраняющейся симптоматике) не должно приводить к отмене предыдущего лечения.
При переходе к третьему шагу терапии из-за недостаточного контроля симптомов основные мероприятия первых двух шагов могут быть продлены, поскольку возможен отсроченный положительный эффект. В алгоритме не представлены некоторые группы препаратов, включая бисфосфонаты. Фаза III клинических исследований эффективности ризедроновой кислоты в отношении контроля симптомов и прогрессирования структурных изменений суставов не закончена, поэтому невозможно сделать окончательный вывод о ее терапевтической активности.
Миорелаксанты также не были включены в алгоритм из-за отсутствия соответствующих исследований при ОА.
Таким образом, выбор рациональной терапии ОА в каждом конкретном случае определяется с учетом предикторов ответа на проводимую терапию, темпов рентгенологического прогрессирования, параметров, влияющих на прогноз, механизмов боли, коморбидного фона, психологического статуса, а также баланса риска и пользы назначаемых препаратов.
Источник
Неослабевающий интерес к проблеме лечения остеоартроза (ОА) продиктован в первую очередь широкой распространенностью и прогрессирующим характером течения этого заболевания, приводящего к снижению или потере трудоспособности, ранней инвалидизации работающего населения и выраженному снижению качества жизни [1].
Согласно официальным данным, ОА занимает ведущее место по распространенности среди ревматических заболеваний. По данным разных авторов, распространенность ОА в популяции колеблется от 5 до 18% [2]. По данным ВОЗ, более 40% лиц пожилого возраста страдают ОА, около 80% больных имеют различные ограничения подвижности, а каждый четвертый больной не может осуществлять повседневную деятельность [3]. В Российской Федерации, по данным официальной статистики, зарегистрировано 3 млн 700 тыс. больных ОА, причем первичная заболеваемость возросла более чем на 20% и составляет 745 тыс. [4]. По данным Департамента здравоохранения г. Москвы, общая заболеваемость ОА составляет 8863 пациента (на 100 тыс. населения), при этом первичная заболеваемость – 803 [5]. Общеизвестно, что данное заболевание чаще встречается у женщин, а также у лиц старше 55 лет [6].
ОА является причиной большого количества обращений за медицинской помощью и основным показанием к назначению лекарственных препаратов (приблизительно 3000 долл. в год на 1 пациента) [7]. В настоящее время затраты на лечение ОА в США колеблются от 15,5 до 26,6 млрд долл. в год, при этом исследователи прогнозируют увеличение стоимости лечения заболевания в ближайшем будущем в несколько раз [8]. В реальной клинической практике, несмотря на проводимую консервативную терапию, заболевание прогрессирует и может вызвать формирование серьезной функциональной недостаточности, приводя к тотальному эндопротезированию суставов, которое является дорогостоящим и инвазивным методом лечения [9].
ОА обычно характеризуется полиартикулярным поражением суставов, однако наиболее типичной локализацией является коленный сустав [10]. По данным недавнего эпидемиологического исследования в РФ, поражение коленных суставов встречается в 92% случаев, тазобедренных — в 42%, суставов кистей – в 38% [11].
В течение длительного времени ОА рассматривался как заболевание суставов, связанное с разрушением суставного хряща, обусловленное старением организма. В последние годы доказано, что ОА – это гетерогенная группа болезней различной этиологии, но с одинаковыми биологическими, морфологическими и клиническими исходами. В патологический процесс вовлекается не только суставной хрящ, но и все структуры сустава: субхондральная кость, связочный аппарат, капсула, синовиальная оболочка и околосуставные мышцы [12].
Факторами риска развития ОА наряду с системными (пол, генетическая предрасположенность, минеральная плотность костной ткани, гормональный статус) являются локальные (травмы, слабость мышц, нарушение оси сустава, дисплазия суставов) и внешние факторы (ожирение, профессиональные факторы, спортивная нагрузка) [13].
Развитие ОА связано с нарушением баланса между разрушением и восстановлением тканей сустава в результате действия механической нагрузки, которая приводит к потере протеогликанов, истончению поверхностных слоев хряща, а при длительном действии этого фактора – к разволокнению пластинки, образованию трещин вплоть до полного исчезновения хряща. Согласно современным представлениям, ОА характеризуется увеличением катаболизма матрикса суставного хряща, ремоделированием костной ткани и воспалением синовиальной оболочки с выработкой провоспалительных медиаторов [14].
Так, исследования последних лет указывают на существенную роль цитокинов в патогенезе ОА, синтез которых может изменяться в зависимости от продолжительности и тяжести заболевания, что свидетельствует в пользу иммунного характера воспаления при этом заболевании [15]. Наибольшее значение имеют ИЛ-1β, ФНО-α, ИЛ-6, –15, –17 и -18. Данные цитокины в повышенных количествах определяются в синовиальной оболочке, синовиальной жидкости и хряще у больных ОА [16]. ФНО-α влияет на блокирование синтеза хондроцитами протеогликанов, белков, связывающих протеогликаны, и коллаген II типа [17]. В хондроцитах цитокины повышают синтез металлопротеаз, а также снижают синтез протеогликанов, тканевого ингибитора металлопротеаз, при этом стимулируют выработку кислородных радикалов, оксида азота, что способствует прогрессированию катаболических процессов в хряще. В свою очередь оксид азота, снижая концентрацию антагониста рецептора ИЛ-1 (ИЛ-1аР), сам активирует ИЛ–1. Кроме того, оксид азота влияет на апоптоз хондроцитов, который в 2–4 раза выше у больных ОА, чем у здоровых лиц. ИЛ-1β стимулирует выработку и других провоспалительных цитокинов – ИЛ-6, -8. Характерной особенностью хондроцитов при ОА является и гиперэкспрессия фермента циклооксигеназы (ЦОГ)-2, индуцирующего синтез простагландинов, участвующих в развитии воспаления [18].
ИЛ-1 влияет на плазминоген, способствуя превращению его в активный плазмин, который, в свою очередь, переводит неактивные проматриксные протеазы в активную форму, усиливая деградацию внеклеточного матрикса. ИЛ-1β повышает экскрецию кальция, активирует остеобласты, в результате чего снижается интенсивность формирования костной ткани. Уменьшение под его влиянием концентрации остеокальцина приводит к разрушению субхондральной кости [19].
В настоящее время терапия ОА направлена на замедление прогрессирования заболевания, облегчение болевых симптомов, уменьшение функциональных нарушений, предотвращение инвалидности и улучшение качества жизни.
Согласно существующим практическим рекомендациям (ACR, EULAR, NICE, АРР от 2013 г.), лечение ОА должно проводиться с использованием комплексного подхода, включающего как немедикаментозные, так и медикаментозные средства.
Принимая во внимание возраст пациентов, полиморбидность, высокие затраты, многочисленные побочные эффекты и осложнения лекарственной терапии, следует отметить, что в настоящее время особенно актуален поиск новых, немедикаментозных методов лечения ОА.
На первом этапе нефармакологического лечения осуществляются доступ к информации и обучение больных. Пациенту необходимо ясно представлять конечные цели лечения заболевания, иметь навыки управления его течением и лечебным процессом, активно сотрудничать с врачом. Для этого пациенту необходимо владеть информацией о своем заболевании, факторах, способствующих его прогрессированию, методах лечения. В 2013 г. EULAR [20] опубликовала обширные рекомендации по нефармакологическому лечению ОА тазобедренных и коленных суставов. Согласно данным рекомендациям, все пациенты должны получить индивидуальный план терапии (уровень доказательности 1b), который включает в себя следующее:
1. Информацию и обучение контролю ОА.
2. Индивидуальную программу физических упражнений.
3. Информацию о поддержании и темпе выполнения нагрузок.
4. Снижение массы тела при избыточном весе и ожирении.
5. Уменьшение влияния негативных механических факторов (например, ношение соответствующей обуви).
6. Использование вспомогательных устройств для ходьбы и соответствующих технологий.
Особое внимание следует обратить на имеющиеся в каждом конкретном случае факторы риска возникновения и прогрессирования ОА. Так, ожирение существенно увеличивает нагрузку на суставы нижних конечностей, по значимости этот фактор даже превосходит наследственность. Не вызывает сомнения, что борьба с лишним весом – эффективная мера профилактики и лечения ОА. Снижение веса на 5% за 6 мес. (более 0,24% за 1 нед.) обеспечивает существенное уменьшение функциональной недостаточности [21]. Снижение веса на 5 кг уменьшает риск возникновения симптомов ОА почти на 50%.
Групповые и индивидуальные занятия лечебной физкультурой (ЛФК) должны быть обязательной частью лечения больных ОА. Основные задачи ЛФК при ОА следующие: предупреждение и коррекция функциональных нарушений; снижение болевого синдрома путем приспособления суставов к дозированной нагрузке; борьба с гипотрофией и атрофией мышц; повышение общего тонуса и трудоспособности. Лечебная гимнастика должна включать статические и динамические упражнения. Выполнять эти упражнения следует регулярно в положении стоя или сидя при максимальном снижении нагрузки на пораженные суставы и обязательно часто, по несколько минут в течение дня. Хотя оптимальная нагрузка и скорость увеличения количества упражнений до сих пор точно не определены, эксперты сходятся во мнении, что интенсивность и длительность физических упражнений следует постепенно увеличивать, чтобы они стали компонентом обычной жизни [20]. Имеется большое количество доказательств, что водные упражнения являются более эффективными [22]. Однако многие авторы считают, что следует рекомендовать пациентам смешанные программы, включающие упражнения на развитие силы (постоянные изометрические) обеих ног, в т. ч. укрепляющие квадрицепс и мышцы передней группы бедра, а также силовые тренировки нижних конечностей вместе с аэробными упражнениями, такими как ходьба [23].
В 2013 г. рабочая группа EULAR единогласно высказалась в пользу ношения удобной обуви для пациентов с ОА (Ib уровень доказательности). Обоснованно применение приспособлений для ходьбы и дополнительных технологий для дома, включающее увеличение высоты стульев, поручни для лестниц и др. (III уровень доказательности). Западноевропейские исследователи [24] оценили в рандомизированном контролируемом исследовании эффективность использования трости в течение 2 мес. у 64 пациентов основной группы.
Медикаментозные препараты, используемые в терапии ОА, делятся на две основные группы: симптом-модифицирующие (анальгетики и нестероидные противовоспалительные препараты (НПВП)), которые быстро купируют боль и воспаление в суставах, и симптом-модифицирующие препараты замедленного действия (symptomatic slow acting drugs for osteoarthritis (SYSADOA)) [25].
В 2014 г. Европейское общество изучения клинических и экономических аспектов остеопороза и остеоартрита (ESCEO) разработало алгоритм лечения ОА коленного сустава для практикующих врачей по итогам анализа данных клинических исследований [26]. На первом этапе лечения ОА коленного сустава рабочая группа ESCEO рекомендует начинать базисную терапию SYSADOA, к которым по необходимости добавляется краткосрочное применение парацетамола для экстренного обезболивания. Парацетамол широко применяется как обезболивающий препарат, несмотря на то, что имеются доказательства высокого риска развития осложнений в верхних отделах ЖКТ и возможного тяжелого поражения печени [27]. Известно, что на фоне приема высоких доз парацетомола (>3 г/сут) снижается почечная функция (снижение скорости гломерулярной фильтрации >30 мл/мин).
Глюкозамина сульфат (ГС) и хондроитина сульфат (ХС) являются сульфатированными гликозаминогликанами, расположенными в экстрацеллюлярном матриксе хряща. В многочисленных исследованиях доказано структурно-модифицирующее (хондропротективное) свойство этих средств, которое обычно наступает после 2–4 нед. лечения и сохраняется в течение 4–8 нед. и более после его прекращения.
ГС стимулирует синтез хондроцитами протеогликанов и гиалуроновой кислоты, достоверно снижает активность матриксных металлопротеиназ, подавляет синтез оксида азота. В систематическом Кохрановском обзоре, который включал рандомизированные исследования высокого уровня доказательности, продемонстрирован значительный эффект ГС на функциональный индекс WOMAC (0,33; 95% ДИ: 0,17–0,48) [28]. В долгосрочном рандомизированном исследовании продемонстрировано, что прием ГС вдвое снизил частоту эндопротезирования коленного сустава по сравнению с группой плацебо [29]. В реальной клинической практике прием 1500 мг ГС снижает потребность в приеме НПВП на 36–50% [30].
ХС входит в состав протеогликановых комплексов матрикса хряща, обладает выраженной гидрофобностью, что способствует сохранению эластических свойств хряща. Высокий уровень доказательности для ХС показан во многих рандомизированных клинических исследованиях (РКИ). В метаанализе у 703 пациентов с ОА эффективность ХС была достоверно выше эффективности плацебо по уровню боли, индексу Лекена [31]. ХС выпускается преимущественно в виде форм для перорального применения, при этом его биодоступность составляет в среднем от 10 до 20%. Внутримышечный способ введения ХС значительно увеличивает биодоступность, и в системном кровотоке препарат выявляется через 30 мин. В открытом проспективном исследовании [32] авторы выявили статистически значимое уменьшение показателей боли, скованности, уменьшение общего WOMAC (95% ДИ: 112–219; p<0,001) ко 2-му мес. терапии ХС. Эффект от проводимой терапии был отмечен у 90% пациентов.
Большая эффективность SYSADOA достигается при их комбинированном применении. Общеизвестно, что ХС оптимизирует состав синовиальной жидкости, а ГС стимулирует выработку ХС. Недавнее исследование показало, что комбинация ХС (1200 мг/сут) и глюкозамина гидрохлорида (ГГ) (1500 мг/сут) не уступала по эффективности (уменьшение боли, восстановление подвижности) целекоксибу [33]. Симптом-модифицирующее и структурно-модифицирующее действие комбинации ГС (1500 мг) и ХС (800 мг) выявлено и в исследовании М. Fransen [34]. После 2-х лет лечения авторами было обнаружено статистически значимое уменьшение сужения суставной щели по сравнению с таковым при применении плацебо (средняя разница – 0,10 мм; 95% ДИ: 0,002–0,20 мм; р=0,046).
Комбинированным препаратом с хондропротективной активностью является Терафлекс (Bayer, Германия), в состав которого входят 500 мг ГГ и 400 мг ХС. Препарат принимают в первые 3 нед. по 1 капсуле 3 р./сут, далее по 1 капсуле 2 р./сут. Таким образом, именно при приеме препарата Терафлекс достигаются суточные дозы хондропротекторов, эффективность которых подтверждена в независимых международных исследованиях. Следует отметить, что эффективность препарата Терафлекс нарастает при длительном (не менее 6 мес.) приеме. В долгосрочном исследовании оценивали эффективность препарата Терафлекс у 224 пациентов с клинически выраженным гонартрозом [35]. Пациенты основной группы принимали Терафлекс в течение 3-х лет по общепринятой схеме с интервалом в 1 мес., контрольная группа принимала диклофенак 100 мг/сут в сочетании с различными видами физиотерапии. Положительный результат при применении препарата Терафлекс в течение 6 мес. достигал 96,8%, а к концу 1 года наблюдения определялись достоверные изменения показателей качества жизни. В группе пациентов, получавших препарат Терафлекс, рентгенологическое прогрессирование к концу 3-го года терапии выявлено в 21,4% случаев, а в контрольной группе – в 32,7% случаев.
Пероральные НПВП играют ключевую роль на втором этапе лечения пациента с ОА, при этом выбор препаратов очень разнообразен. Наиболее важный механизм, который определяет эффективность НПВП, связан с подавлением активности ЦОГ, при этом ЦОГ-1 участвует в регуляции гомеостаза, а уровень ЦОГ-2 существенно увеличивается при развитии воспаления. Риск нежелательных явлений со стороны ЖКТ и сердечно-сосудистой системы необходимо уменьшать до минимума путем тщательного выбора лекарственного препарата.
Кроме того, вероятность развития нежелательных явлений значительно уменьшается при местном использовании НПВП. Особое значение это имеет у пациентов с коморбидными состояниями. Согласно последним рекомендациям OARSI, местное применение НПВП считается более безопасным, такие препараты обладают лучшей переносимостью, чем пероральные НПВП [36]. Большой интерес в этой связи представляют новые комбинированные препараты для местного лечения ОА, содержащие НПВП и хондропротекторы, – например, Терафлекс Хондрокрем Форте. Входящий в его состав мелоксикам является современным НПВП и селективно ингибирует ЦОГ-2 в очаге воспаления, при этом не оказывая повреждающего действия на хрящевую ткань. Второй компонент Терафлекс Хондрокрем Форте – хондроитин, обладает свойствами улучшать реологические свойства синовиальной жидкости и подавлять деструктивные процессы при воспалении суставов. При совместном применении Терафлекса Хондрокрема Форте наблюдается взаимное усиление обезболивающего и противовоспалительного эффектов его отдельных компонентов, что подтверждают результаты клинических исследований. При местном применении Терафлекса Хондрокрема Форте в течение 28 дней положительный эффект терапии был отмечен у 91,2% пациентов, при этом суточное потребление НПВП per os удалось уменьшить в 2 раза по сравнению с исходным уровнем [37].
Таким образом, ГС/ГГ и ХС являются основными и наиболее эффективными SYSADOA при ОА. Терафлекс оказывает противовоспалительное и аналгезирующее действие, а при длительном применении тормозит прогрессирование ОА.
Современный подход к терапии ОА предполагает выбор лекарственных препаратов на основе знаний механизма данного заболевания, что позволяет дифференцированно влиять на болевой синдром и снижать риск нежелательных явлений.
Источник
