Рекомендации по лечению остеоартроза коленного сустава
Согласно последним рекомендациям ESCEO по лечению остеоартрита таковое предполагает применение нефармакологических, фармакологических, а при необходимости хирургических методов. Фармакологическая терапия в свою очередь подразделяется на симптоматическую и структурно-модифицирующую. К симптоматическим препаратам (быстрого действия) относятся анальгетики, опиоиды, нестероидные противовоспалительные препараты. В статье приведены результаты исследований, свидетельствующие, что препарат Нимесил обладает быстро развивающимся клиническим эффектом, высоким профилем безопасности и может быть рекомендован для симптоматического лечения остеоартрита коленного сустава.

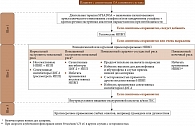
Алгоритм ведения больных ОА коленного сустава (ESCEO 2016)
В структуре всех патологий сустава 80% приходится на остеоартрит (ОА). Остеоартрит – хроническое гетерогенное прогрессирующее заболевание, характеризующееся деградацией экстрацеллюлярного матрикса хряща с последующим ремоделированием тканей сустава. Основные симптомы патологии – болевой синдром и краевые остеофиты.
У пациентов с ОА нарушается функциональная активность суставов и, как следствие, снижается качество жизни.
К факторам риска развития ОА относятся женский пол, дефицит эстрогенов в период постменопаузы, врожденные заболевания костей и суставов, избыточная масса тела, повышенная физическая нагрузка, травмы суставов и др. [1].
Остеоартрит чаще поражает коленные суставы.
Остеоартрит коленного сустава в большей степени распространен среди лиц старше 50 лет.
На сегодняшний день данным заболеванием страдают более 250 млн человек. В связи со старением населения к 2020 г. ОА может стать четвертой по значимости причиной инвалидизации [1].
Вследствие воздействия различных этиологических факторов нарушается обмен и синтетическая активность хондроцитов, а также происходит физико-химическое повреждение матрикса суставного хряща.
В основе нарушения метаболизма хряща при ОА лежит нарушение обмена протеогликанов – основного вещества хряща. Характерным признаком деструкции хряща является потеря матриксом гликозаминогликанов: хондроитинсульфата, кератансульфата, гиалуроновой кислоты. В результате происходит дегидратация хряща, дезорганизация и разрыв коллагеновых волокон. Определенная роль в патогенезе ОА отводится воспалению. Механизм, посредством которого воспаление может участвовать в деградации хряща, – выработка провоспалительных цитокинов (интерлейкинов 1-бета и 6, фактора некроза опухоли альфа и др.). Они в свою очередь способствуют высвобождению ферментов, повреждающих коллаген. Речь, в частности, идет о коллагеназе, эластазе, пептидазе [2].
Лечение должно быть направлено на снижение выраженности симптомов и замедление прогрессирования патологии. Это позволит уменьшить негативное влияние ОА на функциональную активность сустава и качество жизни пациентов, в долгосрочной перспективе – потребность в аналгезии и эндопротезировании.
Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO) в 2014 г. опубликовало рекомендации по лечению ОА коленного сустава, в которых определена приоритетность разных терапевтических вмешательств. Эксперты исходили из эффективности (уменьшение выраженности боли, улучшение функции сустава), безопасности (сокращение риска развития нежелательных явлений), структурно-модифицирующего действия, фармакоэкономики методов лечения.
Появление новых данных стало основанием для обновления рекомендаций. И в 2016 г. ESCEO предложило алгоритм, максимально приближенный к клинической практике (рисунок) [2]. Согласно современным рекомендациям лечение ОА предполагает применение нефармакологических, фармакологических, при необходимости хирургических методов. К важнейшим нефармакологическим методам терапии относятся снижение массы тела и укрепление мышц. Среди фармакологических методов лечения основное место занимают симптоматические (анальгетики, опиоиды, нестероидные противовоспалительные препараты (НПВП)) и структурно-модифицирующие препараты (Symptomatic Slow-Acting Drug in Osteoarthritis – SYSADOA). Первые относятся к средствам быстрого действия, вторые – отсроченного. Их совместное применение обеспечивает эффективность лечения.
На сегодняшний день алгоритм ведения пациентов с ОА состоит из четырех шагов.
Шаг 1. Применение нефармакологических методов.
К немедикаментозным методам относятся физиотерапия, мануальная терапия, бальнеотерапия и физическая активность (например, прогулки).
Однако согласно выводам экспертов ESCEO при оказании первичной медицинской помощи для купирования боли при легком или умеренном ОА следует использовать парацетамол до 3 г/сут.
Применение парацетамола свыше указанной дозы ассоциируется с высоким риском госпитализаций по поводу язвенного дефекта, перфорации или кровотечения в желудочно-кишечном тракте (относительный риск (ОР) 1,20 при 95%-ном доверительном интервале (ДИ) 1,03–1,40).
Длительный прием высоких доз препарата приводит к поражению почек у женщин (OР 2,04 (95% ДИ 1,28–3,24)) – скорость клубочковой фильтрации снижается более чем на 30 мл/мин/1,73 м2, повышению риска развития артериальной гипертензии и у женщин (ОР 2,00 (95% ДИ 1,52–2,62)), и у мужчин (ОР 1,34 (95% ДИ 1,00–1,79)).
Не случайно уже на этом этапе лечения эксперты ESCEO рекомендуют терапию структурно-модифицирующими препаратами с добавлением при необходимости парацетамола для краткосрочного купирования боли. Среди лекарственных средств указанной группы наибольшая доказательная база собрана в отношении глюкозамина сульфата и хондроитина сульфата. Глюкозамина сульфат оказался эффективнее плацебо не только в снижении выраженности боли (стандартизованное среднее различие (ССР) 1,11 (95% ДИ -1,66– -0,57)), но и в улучшении функции суставов (оценивали по индексу Лекена) (ССР -0,47 (95% ДИ -0,82– -0,12)) [3–5].
Систематические обзоры свидетельствуют, что препараты хондроитина сульфата могут оказывать влияние на структурные изменения сустава, их эффективность в отношении симптомов заболевания сопоставима с эффективностью глюкозамина сульфата [4–8]. В исследовании, проведенном М. Hochberq (2014), установлено, что комбинация хондроитина сульфата и глюкозамина сульфата не уступает по силе действия целекоксибу после 180 дней терапии [7].
Таким образом, глюкозамина сульфат и хондроитина сульфат можно рассматривать как средства, обеспечивающие долгосрочный симптом-модифицирующий эффект при ОА, защиту суставного хряща и замедление прогрессирования заболевания [8, 9]. Кроме того, частота нежелательных явлений на фоне такой терапии сопоставима с частотой побочных эффектов при приеме плацебо.
Если на фоне адекватной базисной терапии SYSADOAs (с доказанной эффективностью) и применения парацетамола в качестве экстренной аналгезии симптомы ОА сохраняются, в схему лечения могут быть добавлены топические НПВП или капсаицин. Результаты прямых сравнительных исследований свидетельствуют, что топические НПВП столь же эффективны, что и системные (пероральные) НПВП. Обобщенный эффект в отношении снижения боли при наружном применении НПВП оценен в 0,44 (95% ДИ 0,27–0,62), хотя в отношении указанного показателя между разными препаратами наблюдается значительная гетерогенность (I2 – 69%).
Из-за более низкой системной абсорбции и, как следствие, лучшей переносимости топические НПВП могут иметь предпочтение перед системными (пероральными) НПВП. Это особенно важно для пациентов с ОА 75 лет и старше, лиц с сопутствующими заболеваниями или повышенным риском развития гастроинтестинальных, сердечно-сосудистых или почечных побочных реакций.
Терапия топическими НПВП характеризуется более низким риском развития нежелательных явлений со стороны желудочно-кишечного тракта. В то же время она ассоциируется с повышением частоты легких кожных реакций.
Шаг 2. Использование системных НПВП.
Пероральные НПВП традиционно занимают лидирующие позиции в фармакологическом лечении ОА. Они оказывают умеренное влияние на боль – от 0,29 (95% ДИ 0,22–0,35), что превышает таковое парацетамола – 0,14. Однако прием пероральных НПВП ассоциируется с трех- – пятикратным увеличением риска осложнений со стороны верхних отделов желудочно-кишечного тракта, в том числе перфорации пептической язвы, обструкции и кровотечения. В то же время разные НПВП существенно различаются по частоте гастроинтестинальных и сердечно-сосудистых нежелательных явлений. Экспертная группа ESCEO пациентам с низким (нормальным) гастроинтестинальным риском рекомендует назначать либо неселективные НПВП с/без ингибиторов протонной помпы (ИПП), либо селективные ингибиторы циклооксигеназы (ЦОГ) 2.
Необходимо отметить, что повышение риска осложнений со стороны верхних отделов желудочно-кишечного тракта обусловлено такими факторами, как пожилой возраст, пептическая язва в анамнезе, сопутствующее лечение глюкокортикостероидами (ГКС), аспирином или антикоагулянтами.
В реальной клинической практике выбор перорального НПВП основывается на оптимальном соотношении эффективности, безопасности и стоимости. Одним из препаратов, обладающих таким оптимальным соотношением, является нимесулид (Нимесил) [9–15].
Молекула нимесулида в отличие от молекул других препаратов группы НПВП имеет свойства основания. Это затрудняет ее проникновение в слизистую верхних отделов желудочно-кишечного тракта, как следствие, уменьшается возможность контактного раздражения.
Благодаря высокой биодоступности уже через 30 минут после приема концентрация препарата в крови составляет 50% от пиковой и отмечается выраженный обезболивающий эффект. Максимальная концентрация в плазме крови достигается в среднем через два-три часа, соответственно к этому времени развивается и максимальное анальгетическое действие [12].
Нимесулиду свойственны эффекты, не связанные с класс-специфическим влиянием на синтез простагландинов и определяющие его терапевтическое своеобразие: подавление синтеза провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли альфа), активности металлопротеиназ, ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при ОА, блокирование фосфодиэстеразы 4, повышающей активность клеток воспалительной агрессии – макрофагов и нейтрофилов, а также антигистаминное действие.
Рандомизированные клинические исследования подтверждают мощный и быстрый анальгетический и противовоспалительный эффекты нимесулида. Это определяет целесообразность использования нимесулида (Нимесила) при ОА. Так, терапия нимесулидом у больных ОА коленного и тазобедренного суставов способствовала снижению концентрации маркеров катаболизма хрящевой ткани [13, 14].
Кроме того, отмечено положительное влияние нимесулида на динамику артериального давления (оценивалось по данным суточного мониторирования) у пациентов с артериальной гипертензией. Через 30 дней наблюдения у получавших нимесулид в отличие от принимавших диклофенак не зафиксировано дестабилизации артериального давления. Так, на фоне нимесулида среднее систолическое артериальное давление снизилось с 143 до 140 мм рт. ст., диклофенака – повысилось с 147 до 156 мм рт. ст. (p
Принципиальное значение для оценки безопасности препарата имеют результаты его длительного применения. Так, в работе P. Locker и соавт. 199 пациентов с ОА получали нимесулид 200 мг или этодолак 600 мг в течение трех месяцев. Терапевтический потенциал нимесулида оказался выше: его действие оценили как хорошее или превосходное 80% больных. Этодолаку аналогичную оценку дали 68% пациентов. Несмотря на то что этодолак относится к селективным НПВП, частота побочных эффектов в группах терапии не различалась [14].
На данный момент проведено недостаточно серьезных эпидемиологических исследований, в которых сравнивалась бы гепатотоксичность НПВП. Наиболее значимое среди них – масштабное популяционное исследование, проведенное G. Traversa и соавт. Ученые проанализировали частоту гепатотоксических реакций с 1997 по 2001 г. у 397 537 больных. Суммарное число таких осложнений составило 29,8 на 100 тыс. пациенто-лет. Следовательно, ОР тяжелых гепатотоксических реакций для НПВП составляет 1,4. Для сравнения – частота осложнений со стороны печени при использовании нимесулида составила 35,3 на 100 тыс. пациенто-лет. Это оказалось ниже, чем у диклофенака – 39,2 на 100 тыс. пациенто-лет, кеторолака – 66,8 и ибупрофена – 44,6 [15, 16].
В ретроспективном исследовании, проведенном в Научно-исследовательском институте ревматологии им. В.А. Насоновой, у 322 больных, принимавших нимесулид не менее 12 месяцев, не было отмечено эпизодов клинически выраженной патологии печени: желтухи, гепатомегалии, симптомов печеночной недостаточности. Существенное – более чем двукратное по сравнению с нормальным уровнем – повышение печеночных ферментов зафиксировано лишь у семи (2,2%) больных ревматоидным артритом. Необходимо отметить, что эти пациенты помимо нимесулида получали цитотоксические препараты (метотрексат или лефлуномид) [17, 18].
Исходя из вышесказанного, можно сделать вывод: Нимесил – универсальное средство для лечения ОА, в котором сочетаются быстрота действия, хороший анальгетический и значимый противовоспалительный эффекты. По переносимости Нимесил превосходит многие традиционные НПВП. Препарат относительно редко вызывает диспепсию и другие осложнения со стороны желудочно-кишечного тракта.
Избегать применения пероральных НПВП экспертная группа ESCEO рекомендует пациентам с повышенным риском развития нежелательных явлений со стороны почек, например с хронической болезнью почек и скоростью клубочковой фильтрации ниже 30 мл/мин/1,73 м2.
Из соображений безопасности и в отсутствие долгосрочных исследований рекомендуется использовать пероральные НПВП эпизодически или курсами, в минимальной эффективной дозе и в течение как можно более короткого времени, необходимого для контроля над симптомами.
При противопоказаниях к НПВП или сохранении симптомов, несмотря на проводимое лечение, следует рассмотреть возможность внутрисуставного введения препаратов гиалуроновой кислоты или ГКС.
Экспертная группа ESCEO указывает, что гиалуроновую кислоту необходимо назначать пациентам с ОА коленного сустава легкой или умеренной степени тяжести, а также лицам с более тяжелым заболеванием, которым противопоказано тотальное эндопротезирование коленного сустава или которые хотят отсрочить операцию. Препараты гиалуроновой кислоты для интраартикулярного введения показаны в отсутствие признаков острого воспаления. При наличии таковых в качестве терапии первой линии внутрь сустава следует вводить ГКС. Одновременное интраартикулярное введение гиалуроновой кислоты и ГКС не рекомендуется из-за риска межлекарственного взаимодействия. Таковое станет возможным, когда будет доказана их фармацевтическая совместимость.
Шаг 3. Предоперационная терапия.
Пациентам, ожидающим операцию, рекомендуется краткосрочное применение опиоидных препаратов (например, трамадола) и антидепрессантов.
Слабые опиоиды назначаются при тяжелых симптомах ОА.
В отличие от обычных опиатов трамадол редко вызывает угнетение дыхания и зависимость. Кроме того, его использование не ассоциируется с повышением риска гастроинтестинальных и сердечно-сосудистых осложнений, характерных для НПВП.
Наиболее частые побочные эффекты терапии трамадолом – тошнота и головная боль. В некоторых случаях они могут стать причиной прекращения лечения либо недостаточного обезболивания.
Риск побочных реакций может быть снижен благодаря медленной титрации дозы и приему трамадола медленного высвобождения (от 50 до 100 мг/сут в течение семи дней).
По мнению экспертов ESCEO, кратковременное применение трамадола может быть показано пациентам с очень выраженными симптомами ОА.
Антидепрессанты, в том числе дулоксетин, используют при хроническом болевом синдроме. Они обладают центральным механизмом действия, влияя на болевые нейромедиаторы (серотонин и норадреналин). Однако доказательства эффективности антидепрессантов при ОА ограничены, а частота нежелательных явлений достаточно высока.
Шаг 4. Замена сустава и другие хирургические процедуры.
В качестве альтернативы хирургическому вмешательству на этом этапе предлагается назначать опиоидные анальгетики для перорального или трансдермального введения.
В рекомендациях ESCEO за 2016 г. рассмотрены все современные методы лечения ОА, которые включены в алгоритм ведения больных. Исследовательская группа ESCEO полагает, что представленная мультимодальная программа должна применяться у всех больных.
Когда пациент переходит ко второму шагу – терапии пероральными НПВП, лечение, предусмотренное на первом шаге, должно продолжаться, так как оно по-прежнему влияет на течение заболевания.
Аналогичным образом решение о необходимости внутрисуставного введения гиалуроновой кислоты и ГКС (при сохраняющейся симптоматике) не должно приводить к отмене предыдущего лечения.
При переходе к третьему шагу терапии из-за недостаточного контроля симптомов основные мероприятия первых двух шагов могут быть продлены, поскольку возможен отсроченный положительный эффект. В алгоритме не представлены некоторые группы препаратов, включая бисфосфонаты. Фаза III клинических исследований эффективности ризедроновой кислоты в отношении контроля симптомов и прогрессирования структурных изменений суставов не закончена, поэтому невозможно сделать окончательный вывод о ее терапевтической активности.
Миорелаксанты также не были включены в алгоритм из-за отсутствия соответствующих исследований при ОА.
Таким образом, выбор рациональной терапии ОА в каждом конкретном случае определяется с учетом предикторов ответа на проводимую терапию, темпов рентгенологического прогрессирования, параметров, влияющих на прогноз, механизмов боли, коморбидного фона, психологического статуса, а также баланса риска и пользы назначаемых препаратов.
Источник
Этиология и патогенез.
Различают первичный и вторичный ОА.
Общими факторами развития ОА можно считать несоответствие между механической нагрузкой на суставной хрящ и его возможностями сопротивляться воздействию.
Этиология первичного ОА окончательно не изучена.
По современным представлениям ОА является многофакторным заболеванием. В его развитии большую роль играет взаимодействие эндогенных и экзогенных факторов, таких как: пожилой возраст, пол, наследственная предрасположенность, аномалии развития, профессиональная деятельность, избыточная масса тела, функциональная перегрузка сустава (профессиональная деятельность, спортивная активность), травмы.
Гиалиновый хрящ состоит из хондроцитов и внеклеточного вещества — ма-трикса.
Хондроциты обладают высокой синтетической активностью и вырабатывают все компоненты матрикса: коллаген II типа, сульфатированные гли-козаминогликаны (которые в дальнейшем объединяются в протеогликаны), протеолитические ферменты (агреканазы, матриксные металлопротеазы) и большое количество медиаторов, принимающих участие в метаболизме хрящевой ткани. Нормальное строение хряща обеспечивает его эластичность. Коллаген II типа образует волокнистый каркас матрикса.
Протеогликаны, заполняющие петли коллагенового каркаса, обладают высокой гидрофильностью и связывают большое количество воды. При давлении вода вытесняется и вновь возвращается после прекращения воздействия (эффект «мокрой губки»). Протеолитические ферменты вызывают деградацию коллагена и протеогликанов, т. к. катабо-лические процессы необходимы для обновления компонентов матрикса хряща. В норме процессы анаболизма и катаболизма находятся в равновесии.
Возможно, под действием этиологических факторов (например, избыточная механическая сила) хондроциты и синовиациты начинают синтезировать воспалительные медиаторы (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-17, 18), которые вызывают повышение ката-болической активности хондроцитов.
В свою очередь, протеолитические процессы инициируют синтез хондроцитами факторов роста (костный морфоген-ный протеин 2, 7, инсулиноподобный фактор роста, трансформирующий фактор роста р и другие), которые стимулируют синтез компонентов матрикса, но также способствуют росту остеофитов и повышению жесткости субхондральной кости, что еще больше способствует деградации хряща, образуя порочный круг.
В ранних стадиях ОА хрящ утолщается, но постепенно происходит его истончение.
Хондроциты в ранней стадии ОА активно синтезируют компоненты матрикса, однако полноценной репарации не происходит. Считается, что при воздействии неблагоприятных факторов, наиболее ранними и необратимыми проявлениями ОА является разрушение коллагенового каркаса. Установлено, что в артрозном хряще концентрация металлопротеаз повышена на 150% при минимальном увеличении ингибитора данной протеазы. При прогрессировании болезни хрящ разволокняется, образуются эрозии, трещины, а затем наблюдается полная потеря гиалинового хряща.
Диагностика
МРТ коленного сустава при остеоартрозе
Остеоартроз — клинические рекомендации 2020 включают инструментальные методы обследования диагностики остеоартроза — УЗИ, МРТ позволяют выявить повреждение хряща, отек костного мозга, субхондральные кисты, патологию мениска, связочного аппарата, остеофиты.
Рентгенологически определяют стадию болезни по ширине суставной щели, наличию остеофитов, субхондрального склероза, а также остеопороза.
Специальных лабораторных признаков болезни нет, показатели воспаления — СОЭ, ЦР-белок, как правило, не повышены. Биомаркеры костной, хрящевой деструкции, иммунного воспаления достаточно сложны в исполнении и дороги для широкого использования.
Клиника.
Наиболее часто поражаются суставы, испытывающие наибольшие функциональные перегрузки: тазобедренные, коленные суставы, плюсно-фаланговые суставы 1-х пальцев стоп, суставы кистей (дистальные и проксимальные межфаланговые, запястно-пястный сустав 1 -го пальца).
Основные клинические признаки ОА:
— Постепенное начало заболевания;
— Усиление боли при физической нагрузке и ослабление в покое;
— Продолжительная (недели и более) боль в суставах, которая усиливается во время нагрузки на суставы и уменьшается в покое;
- Крепитация (хруст, треск или скрип) пр(1 активном движении;
- Утренняя скованность продолжительностью не более 30 мин. и скованность после периодов иммобилизации сустава («феномен геля»);
- Ограничение объема движений в суставе.
ОА коленного сустава — наиболее частая локализация ОА, в 3(МО% является первичным. Обычно протекает легче, чем коксартроз, однако способствует развитию функциональных ограничений в обычной жизни (например, подъем со стула; сгибание для одевания носков, обуви; подъем и спуск по лестнице; пользование транспортом).
Особенности боли при гонартрозе:
- Обычно ограничивается передней и медиальной областью сустава и верхней частью голени;
- Усиливается при ходьбе по лестнице или по пересеченной местности;
- Боль по задней поверхности сустава может быть проявлением осложнения — подколенной кисты (киста Бейкера).
ОА тазобедренного сустава — наиболее тяжелая форма ОА, обычно заканчивается инвалидизацией больного. Если коксартроз развивается в возрасте до 40 лет, то это обычно связано с врожденной патологией головки бедра.
Особенности боли при коксартрозе:
- Наиболее выражена в паховой области, может иррадиировать в ягодицу, по переднебоковой поверхности бедра, в колено, в голень;
- Провоцируется движениями в тазобедренном суставе;
- Боль по латеральной поверхности бедренного сустава, усиливающаяся в положении лежа на этом боку, сопровождающаяся болезненностью при пальпации большого вертела, указывает на вторичный бурсит.
ОА межфаланговых суставов кисти — узелки Гебердена — характеризуется костными разрастаниями в области дистальных межфаланговых суставов и является наиболее частой формой идиопатического ОА. В 10 раз чаще встречается у женщин. Костные разрастания в области проксимальных межфаланговых суставов называют узелками Бушара. Обычно узелки растут медленно и не вызывают неприятных ощущений. Существует генетическая предрасположенность к образованию узелков. Риск их появлений У дочери больной увеличивается в 2 раза. Диагностическая ценность узелков Гебердена и Бушара состоит в том, что данные изменения типичны только для первичного ОА.
ОА запястно-пястного сустава большого пальца («рука фермера», «квадратная кисть») — частая локализация ОА. Обычно сопровождается припухлостью, болезненностью, хрустом в суставе. В выраженной стадии заболевания отмечается деформация кисти с резким ограничением подвижности вплоть до потери
трудоспособности.
Что такое остеоартроз
Согласно официальной статистике, в России более 4 миллионов человек преимущественно старшей возрастной группы страдает этим недугом. Раньше остеоартроз связывали со старением организма. Пациенты часто слышали от врача: «Ну что же вы хотите, возраст…»
Сегодня болезнь значительно помолодела, ее расценивают как хроническое, медленно прогрессирующее воспалительное заболевание, при котором поражается не только хрящ, но и все структуры сустава — синовиальная оболочка, субхондральная кость, места прикрепления связок к кости, мышцы.
Исследования последних лет показали, что синовиальная жидкость у больных остеоартрозом подвержена тем же иммунологическим изменениям, что и при ревматоидном артрите. Поэтому сейчас заболевание у нас в стране и за рубежом называют остеоартритом.
Начальные проявления остеоартроза, при которых происходят изменения в клетках хряща, пациент, как правило, не замечает и к врачу обращается, лишь когда появляется боль. Ограничивая подвижность человека, боль порождает беспомощность, страх, бессонницу, депрессию.
А если учесть, что у пожилых людей остеоартроз (ОА) часто протекает одновременно с сахарным диабетом, артериальной гипертензией, другими сердечно-сосудистыми заболеваниями, то жизнь становится не в радость.
Но так ли все беспросветно? Постараемся разобраться и вселить оптимизм, заметив только, что пациентам придется приложить усилия, чтобы отсрочить недуг, а если он имеется — побороться с ним.
Общая информация
1.1 Определение
Остеоартроз (ОА) — поражение всех компонентов сустава различной этиологии со сходными проявлениями и исходом.
Патологический процесс возникает в результате взаимодействия возрастных, гормональных, генетических и средовых факторов.
1.3 Эпидемиология
Самое частое заболевание суставов — более 10% населения.
С 2000 по 2010 год в РФ число больных ОА увеличилось почти в 2.5 раза.
В России распространенность коленного и (или) тазобедренного ОА у населения старше 18 лет -13%.
М15 – Первичный генерализованный остеоартроз;
М15.1 – Узлы Гебердена;
М15.2 – Узлы Бушара;
М18 – Артроз 1-го запястно-пястного сустава;
М19 – Другие остеоартрозы.
1.5. Классификация
Локальный — поражение одной группы суставов.
Генерализованный — поражение 3 и более суставных групп.
Краткое описание
МКБ-10: М15–М19 Артрозы
Аббревиатура: ОА — остеоартроз
Классификация
- I.Первичный (идиопатический).А. Локализованный.
Б. Генерализованный (3 группы суставов и более).
— С поражением дистальных и проксимальных межфаланговых суставов.
— С поражением крупных суставов.
Б. Врожденные, приобретенные или эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.).
В. Метаболические болезни (охроноз, гемохроматоз, болезнь Вильсона, болезнь Гоше).
Г. Эндокринопатии (акромегалия, гиперпаратиреоз, СД, гипотиреоз).
Д. Болезнь отложения кальция (фосфат кальция, гидроксиапатит).
Е. Нейропатии (болезнь Шарко).
Ж. Другие заболевания (аваскулярный некроз, РА, болезнь Педжета).
0 — Изменения отсутствуют.
1 — Сомнительные рентгенологические признаки.
II — Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты).
III — Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты).
IV — Выраженные изменения (суставная щель почти не прослеживается, выявляют грубые остеофиты).
КОД по МКБ-10: М 15-М 19 Артрозы
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
Список литературы
• Lanyon P. , Muir K. , Doherty S. , Doherty M. Assessment of a genetic contribution to osteoarthritis of the hip: sibling study BMJ. 2000; 321(7270):1179–83. • Cunningham L. S, Kelsey J. L. Epidemiology of musculoskeletal impairments and associated disability Am J Public Health 1984; 74:574–579. • Branco J. C. , Rodrigues A. M. , Gouveia N.
results from a population survey in Norway J Rheumatol 2008; 35(4):677-84. • Балабанова Р. М. , Эрдес Ш. Ф. Динамика распространенности ревматических заболеваний, входящих в XIII класс МКБ-10, в популяции взрослого населения Российской Федерации за 2000-2010 гг. Научно-практическая ревматология, 2012; 52(3), 10-12. • Галушко Е. А.
, Большакова Т. В. , Виноградова И. Б. И тд; Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования (предварительные результаты). Научно-практическая ревматология. 2009; № 1: 11–17. • Kellgren, J. H. , Lawrence J. S. Radiological assessment of osteoarthrosis Annals of the Rheumatic Diseases 1957; 16(4): 494–502. • Zhang W. , Doherty M. , Peat G.
, et al EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis Ann Rheum Dis 2010; 69(3):483-9. • Zhang W. , Doherty M. , Leeb B. F. , Alekseeva L. Etal EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann Rheum Dis 2009; 68:8–17. • Altman R. , Alarcon G.
, Appelrouth D. , Bloch D. , Borenstein D. , Brandt K. Et al The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip Arthritis Rheum 1991; 34:505-514. • Смирнов А. В. Рентгенологическая диагностика изменений в тазобедренном суставе при ревматических заболеваниях. Consilium Medicum 2003; 5 (8): 442-6. • Altman R. , Asch E. , Bloch D. , Bole G.
, Borenstein D. , Brandt K. Et al The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the knee Arthritis Rheum 1986; 29:1039-49. • Altman R. , Alarcn G. , Appelrouth D. , Bloch D. , Borenstein D. , Brandt K. Et al The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand Arthritis Rheum 1990; 33:1601-10. • Jordan K. M. , Arden N. K. , Doherty M.
, Bannwarth B. , et al EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) Ann Rheum Dis 2003; 62:1145–1155. • Machado G. C. , Maher C. G. , Ferreira P. H. , Pinheiro M. B.
, et al Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomised placebo controlled trials BMJ 2015; 350:h1225. • Williams H. J. , Ward J. R. , Egger M. J. , et al Comparison of naproxen and acetaminophen in a two-year study of treatment of osteoarthritis of the knee Arthritis Rheum 1993; 36:1196–1206. • Rahme E. , Barkun A. , Nedjar H. , Gaugris S. , Watson D.
Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the elderly in Quebec, Canada Am J Gastroenterol 2008; 103:872–82. • Curhan G. C. , Knight E. L. , Rosner B. , Hankinson S. E. , Stampfer M. J. Lifetime nonnarcotic analgesic use and decline in renalfunction in women Arch Intern Med 2004; 164:1519–24. • Forman J. P. , Rimm E. B. , Curhan G. C.
report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) Ann Rheum Dis 2005; 64:669–681. • Zhang W. , Moskowitz R. W. , Nuki G. , et al OARSI recommendations for the management of hip and knee osteoarthritis, part II: OARSI evidence-based, expert consensus guidelines Osteoarthritis Cartilage 2008; 16: 137–62.
a double-blind, randomised trial Lancet 2007; 369:1621-1626. • Rangnekar A. S. , Fontana R. J. An update on drug induced liver injury Minerva Gastroenterol Dietol 2011; 57(2):213-29. • Fored C. M. , Ejerblad E. , Lindblad M. Et al Summing the risk of NSAID therapy Lancet 2007; Vol 369. P. 1580 -1581. • Bannuru R. R. , Schmid C. H. , Kent D. M.
, etal Comparative effectiveness of pharmacologic interventions for knee osteoarthritis:a systematic review and network meta-analysis Ann Intern Med 2015; 162(1):46-54. • Zhang W. , Doherty M. , Leeb B. F. , et al EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT).
Royal College of Physicians, 2008. • Zhang W. , Doherty M. , Arden N, et al EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2005; 64: 669–81. • Zhang W. , Nuki G. , Moskowitz R. W.
a systematic review and meta-analysis Arthritis Rheum2009; 61(12):1704-11. • Rovetta G. , Monteforte P. , Molfetta G. , Balestra G. A two-years study of chondroitin suffate in erosive osteoarthritis of the hand: behavior of erosions, osteophytes, pain and hand dysfunction Drug Exp Clin Res, 2004; 30(1):11-16. • Pawelka K. , Gatterova J.
, Olejarova M, et al Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3 year, randomized, placebo-controlled, double-blind study Arch Intern Med 2002; 162:2113–23. • Poolsup N. , Suthisisang C. , Channark P. , Kittikulsuth W. Glucosamine long-term treatment and the progression of knee osteoarthritis: systematic review of randomized controlled trials Ann Pharmacother 2005; 39:1080-87. • Kahan A.
OARSI evidence-based, expert consensus guidelines Osteoarthritis Cartilage 2008; 16: 137–62. • Fidelix T. S. , Macedo C. R. , Maxwell L. J. , Fernandes Mo?a Trevisani V. Diacerein for osteoarthritis Cochrane Database Syst Rev 2014; 2:CD005117. • Pham T. , Le Henanff A. , Ravoud P. , at al Evaluation of the symptomatic and structural efficacy of a new hyaluronic acid compound, NRD101, in comparison with diacerhein and placebo in a 1 year randomised controlled study in symptomatic knee osteoarthritis Ann Rheum Dis 2004; 63:1611–7.
• Christensen R. , Bartels E. M. , Astrup A. , Bliddal H. Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials Osteoarthritis Cartilage 2008; 16:399–408. • Ernst E. Avocado/soybean unsaponifiables (ASU) for osteoarthritis – a systematic review Clin Rheumatol 2003; 22:285-8. • Lequesne M. , Maheu E. , Cadet C.
, et al Structural effect of avocado/soybean unsopanifiables on joint space loss in osteoarthritis of hip Arthritis Care Research 2002; 47:50-58. • Maheu E. , Cadet C. , Marty M. , et al Randomised, controlled trial of avocado-soybean unsaponifiable (Piascledine)effect on structure modification in hip osteoarthritis: the ERADIAS study Ann Rheum Dis 2014; 73(2):376-84. • Bruyere O. , Burlet N. , Delmas P. D.
a systematic review Osteoarthritis Cartilage 2006; 14:1306–11. • Bannuru R. R. , Natov N. S, Obadan I. E. , et al Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis:a systematic review and meta-analysis Arthritis Care Res 2009; 61:1704–11. • MacLean C. H. Quality indicators for the management of osteoarthritis in vulnerable elders Ann Intern Med 2001; 135(8 Pt 2):711–21. • Soderman P. , Malchau H. , Herberts P.
Outcome after total hip arthroplasty Part I. General health evaluation in relation to definition of failure in the Swedish National Total Hip Arthroplasty register Acta Orthop Scand 2000; 71:354–9. • Kroon F. P. , van der Burg L. R. , Buchbinder R. ,etal Self-management education programmes for osteoarthritis Cochrane Database Syst Rev 2014; 1:CD008963. • Hansson E. E.
, Jonsson-Lundgren M. , Ronnheden A. M. , etal Effect of an education programme for patients with osteoarthritis in primary care a randomized controlled trial BMC Musculoskelet Disord 2010; 11:244. • Allen K. D. , Oddone E. Z. , Coffman C. J. , etal Telephone-based self-management of osteoarthritis: a randomized trial Ann Intern Med 2010; 153(9):570-9.
• Anandacoomarasamy A. , Leibman S. , Smith G. , et al Weight loss in obese people has structure-modifying effects on medial but not on lateral knee articular cartilage Ann Rheum Dis 2012; 71:26-32. • Richette P. J. , Pointou C. , Garnero P. Benefi cial eff ects of massive weight loss on symptoms, joint biomarkers and systemic infl ammation in obese patients with knee OA.
Ann Rheum Dis 2011; 70: 139–44. • Messier S. P. , Mihalko S. L. , Legault C. , etal Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial J Am Med Assoc 2013; 310:1263–73. • Roddy E. , Zhang W. , Doherty M.
Aerobic walking or strengthening exercise for osteoarthritis of the knee{amp}amp; A systematic review Ann Rheum Dis 2005; 64: 544–48. • Conn V. , Hafdahl A. , Minor M. , Nielsen P. Physical activity interventions among adults with arthritis: Meta-analysis of outcomes Seminars in Arthritis and Rheumatism 2008; Vol37, suppl5. , 307. • Zhang W.
a systematic review and meta-analysis Osteoarthritis Cartilage 2015; 23(2):178-88. • Duivenvoorden T. , van Raaij T. M. , Horemans H. L. , etal Do laterally wedged insoles or valgus braces unload the medial compartment of the knee in patients with osteoarthritis? Clin Orthop Relat Res 2015; 473(1):265-74. • Parkes M. J. , Maricar N. , Lunt M.
, etal Lateral wedge insoles as a conservative treatment for pain in patients with medial knee osteoarthritis: a meta-analysis JAMA. 2013; 310(7):722-30. • Malvankar S. , Khan W. S. , Mahapatra A. , Dowd GS. How Effective are Lateral Wedge Orthotics in Treating Medial Compartment Osteoarthritis of the Knee? A Systematic Review of the Recent Literature Open Orthop J. 2012; 6:544-7. • Simic M. , Hinman R. S. , Wrigley T. V.
, etal Gait modification strategies for altering medial knee joint load: a systematic review Arthritis Care Res (Hoboken). 2011; 63(3):405-26. • Watt F. E. , Kennedy D. L. , Carlisle K. E. , etal Night-time immobilization of the distal interphalangeal joint reduces pain and extension deformity in hand osteoarthritis Rheumatology (Oxford). 2014; 53(6):1142-9. • Bertozzi L. , Valdes K. , Vanti C.
, etal Investigation of the effect of conservative interventions in thumb carpometacarpal osteoarthritis: systematic review and meta-analysis Disabil Rehabil 2020, 1-19. • Jones A. , Silva P. G. , Silva A. C. , Colucci M. , etal Impact of cane use on pain, function, general health and energy expenditure during gait in patients with knee osteoarthritis: a randomised controlled trial Ann Rheum Dis 2012; 71(2):172-9.
