Костная аутопластика коленного сустава
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Баитов В.С.
1
Гуражев М.Б.
1
Прохоренко В.М.
1, 2
1 ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России
2 ФГБОУ ВО «НГМУ» Минздрава России
Коленный сустав является биомеханически самым сложным суставом, что обусловливает его повышенную уязвимость перед дегенеративно-дистрофическими заболеваниями и в конечном итоге приводит к тотальному эндопротезированию коленного сустава. Одна из проблем, которую нужно решить в процессе тотального эндопротезирования коленного сустава, это замещение костных дефектов в ложе эндопротеза, доля которых составляет от 25 до 31%. Существующие способы замещения костных дефектов имеют свои преимущества и недостатки. Преимущество аутопластики заключается в технической простоте и максимальном сохранении, а со временем и восстановлении костной ткани метаэпифиза, что очень важно при первичном и ревизионном эндопротезировании коленного сустава. Однако, как и любой другой способ, аутопластика имеет свои показания и противопоказания. Авторами разработан и внедрен в клиническую практику метод аутопластики костного дефекта большеберцовой кости при первичном эндопротезировании коленного сустава. Выполнение аутопластики по разработанной методике приводит к хорошим результатам, выражающимся в создании долговременной надежной опоры для компонентов эндопротеза, что увеличивает срок его службы за счет нормализации распределения нагрузок в прооперированном коленном суставе.
коленный сустав
эндопротезирование
костный дефект
аутопластика
1. Hylkema T.H., Stevens M., Van Beveren J. et al. Preoperative characteristics of working-age patients undergoing total knee arthroplasty. PloS one. 2017 Aug; 12(8):e0183550 DOI: 10.1371/journal.pone.0183550.
2. Прохоренко В.М., Павлов В.В., Баитов В.С. и др. Опыт эндопротезирования коленного сустава в Новосибирском НИИТО // Эндопротезирование в России: Вып. 1: Всерос. монотематич. сб. науч. тр. — Казань-СПб.: АБАК, 2005. – С. 238-241.
3. Корнилов Н.Н., Новоселов К.А. Особенности асептического некроза мыщелков бедренной и большеберцовой костей // Травматология и ортопедия России. – 2003. – № 1. – С. 76–81.
4. Ponzio D.Y., Austin M.S. Metaphyseal bone loss in revision knee arthroplasty. Curr Rev Musculoskelet Med. 2015 December; 8(4): 361–367. Published online 2015 September 11. doi: 10.1007/s12178-015-9291-x
5. Panegrossi G., Ceretti M., Papalia M. et al. Bone loss management in total knee revision surgery. Int Orthop. 2014 February; 38(2): 419–427. Published online 2014 January 10. doi: 10.1007/s00264-013-2262-1.
6. Indelli P.F., Giori N., Maloney W. Level of constraint in revision knee arthroplasty. Curr Rev Musculoskelet Med. 2015 December; 8(4): 390–397. Published online 2015 September 15. doi: 10.1007/s12178-015-9295-6.
7. Huff T.W., Sculco T.P. Management of bone loss in revision total knee arthroplasty. J Arthroplasty. 2007; 22(suppl. 3): 32-36.
8. Engh G.A. Bone loss classification. Revision total knee arthroplasty. Williams and Wilkins, Baltimore. 1997: 63-120.
9. Iamaguchi M.M., Helito C.P., Gobbi R.G. et al. Value of preoperative radiographic evaluations on knee bone defects for revision arthroplasty. Rev Bras Ortop. 2012; 47(6): 714–718. Published online 2015 November 4. doi: 10.1016/S2255-4971(15)30027-6.
10. Tigani D., Dallari D., Coppola С. et al. Total knee arthroplasty for post-traumatic proximal tibial bone defect: three cases report. Open Orthop J. 2011; 5: 143–150. Published online 2011 April 14. doi: 10.2174/1874325001105010143.
11. Yi Yan Qiu, Chun Hoi Ya, Kwong Yuen Chiu, Fu Yuen Ng. Review Article: Treatments for Bone Loss in Revision Total Knee Arthroplasty. J Orthopaedic Surgery. 2012; 20(1): 78-86. Published online 2012 April 1. doi: 10.1177/230949901202000116.
12. Корнилов Н.Н. Замещение костных дефектов при первичном эндопротезировании коленного сустава / Н.Н. Корнилов, Т.А. Куляба, Р.М. Тихилов и др. // Травматология и ортопедия России. – 2008. – № 1 (47). – С. 76-81.
13. Rossi B., Jayasekera N., Kelly F.A., Eyres K. Patients’ Perception of Bone and Tissue Excision, and the Size and Weight of Prostheses at Total Knee Arthroplasty. Surgery Journal N.Y. 2017 Jul.; 3(3):e110-e112 DOI: 10.1055/s-0037-1604010.
14. Баитов В.С., Прохоренко В.М., Русова Т.В. Биохимические критерии диагностики при гонартрозе // Травматология и ортопедия XXI века: сб. тез. докл. VIII съезда травматологов-ортопедов России, г. Самара, 6-8 июня 2006 г. — Т. I. – С. 598.
15. Martinez-Cano J.P., Herrera-Escobar J.P., Arango Gutierrez A.S. et al. Prospective quality of life assessment after hip and knee arthroplasty: short- and mid-term follow-up results. Arthroplasty Today. 2017; 3(2):125-130.
По данным литературы, доля заболеваний коленного сустава среди всех случаев дегенеративно-дистрофических заболеваний суставов конечностей составляет от 21,9 до 29%, причем в 86% случаев страдают лица трудоспособного возраста, у которых прогрессирование заболевания в течение 10-15 лет приводит к инвалидности в 6,2-14,6% случаев [1]. Зачастую методом выбора при лечении пациентов с дегенеративно-дистрофическими заболеваниями суставов становится тотальное эндопротезирование. Одной из проблем, которую нужно решить в процессе тотального эндопротезирования сустава, это замещение костных дефектов в ложе эндопротеза. Их доля при заболеваниях коленного сустава составляет от 25 до 31% [2].
Причинами формирования дефектов и, как следствие, грубых деформаций являются:
— асептический некроз мыщелков, который, по данным различных авторов, составляет от 8 до 22% всех дегенеративно-дистрофических заболеваний коленного сустава,
— кистовидная перестройка эпифизов бедренной и большеберцовой костей,
— посттравматическая импрессия суставной поверхности [3-6].
Существует достаточное количество классификаций костных дефектов при первичном и ревизионном эндопротезировании коленного сустава [7]. Мы используем наиболее удобную, нашедшую широкое клиническое и научное применение классификацию AORI, разработанную G.A. Engh в Anderson Ortopaedic Research Institute (AORI США, 1997) [8]. Классификация основана на дооперационной рентгенологической оценке состояния костей, с помощью предварительно заданных критериев. В соответствии с этой классификацией выделяют четыре типа состояния бедренной или большеберцовой костей:
1 тип – интактная кость;
2А тип – повреждённая губчатая кость, кость противоположного мыщелка остается неизменной;
2В тип – симметричная потеря костной массы с вовлечением обоих мыщелков или плато;
3 тип – повреждение губчатой и кортикальной кости.
Классификация AORI достаточно четко показывает корреляцию наличия и размеров костных дефектов с ростом потребности использовать металлические блоки, клинья и/или структурированные трансплантаты. У данной методики существует лишь один минус. По современным данным, в группах I и IIA дефекты кости до 5 мм в 46% случаев посредством дооперационных рентгенограмм диагностированы не были [9].
При выполнении тотального эндопротезирования коленного сустава (ТЭКС) преследуется основная цель – создание долговременной надежной опоры для компонента эндопротеза. В случае имеющегося костного дефекта она может достигаться такими способами, как:
— резекция по дну дефекта,
— цементная пластика с армированием или без армирования,
— костная аутопластика,
— замещение металлическим блоком,
— костная аллопластика [10-12].
При детальном рассмотрении у каждого метода отмечаются свои преимущества и недостатки. Преимуществом замещения костного дефекта путем выполнения резекции по дну дефекта является простота и быстрота выполнения. Недостатком становится снижение количества ткани большеберцовой кости в дистальном направлении. Не исключена ситуация, что на максимальном вкладыше стабильность сустава не будет достигнута. Кроме того, при возникновении необходимости выполнения реэндопротезирования у этой группы пациентов хирург может столкнуться с такой проблемой, как обширный дефект большеберцовой кости. Таким образом, этот вариант замещения костного дефекта не является методом выбора. Его применение допустимо при неглубоких дефектах [12]. По нашим данным, резекция по дну дефекта выполнена у 5% пациентов с имеющимся костным дефектом.
Замещение костного дефекта путем цементной пластики с армированием или без армирования винтами также отличается простотой и дешевизной. Недостатки метода заключаются в том, что непросто добиться адекватной прессуризации цемента при нарушении целостности кортикальной кости. Изменение объема цемента во время полимеризации может достигать 2%. Неравномерное распределение нагрузки на подлежащую кость при эксцентрически действующих силах может приводить к нарушению прочности фиксации. Этот метод используется для замещения достаточно глубоких дефектов, при условии соблюдения правил прессуризации цемента и планирования вектора нагрузки [12]. По нашим данным, такое замещение выполнено у 82% пациентов с имеющимся костным дефектом.
Преимущество метода замещения костного дефекта путем костной аутопластики заключается в максимальном сохранении костной ткани метаэпифиза. К недостаткам метода относятся: существенные ограничения в выборе размера трансплантата, риск коллапса, если структура трансплантата повреждена патологическим процессом, и риск несращения. Метод применяется при наличии трансплантата с соответствующими характеристиками (размер, плотность). По нашим данным, такое замещение выполнено у 7% пациентов с имеющимся костным дефектом.
Достоинством замещения костного дефекта металлическим блоком или клином следует считать быстрое создание надежной опоры для имплантата, даже в условиях обширных дефектов. К недостаткам метода относятся ограничения по размеру и форме трансплантата, необходимость специальных инструментов и компонентов эндопротеза. Увеличивается общая стоимость имплантата. При наличии специального инструментария и соблюдении правил имплантации метод применим для замещения любых дефектов [12; 13]. По нашим данным, замещение костного дефекта этим методом выполнено у 6% пациентов.
Цель исследования: улучшить результаты первичного эндопротезирования коленного сустава у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI.
Материал и методы. В Новосибирском НИИТО за 2012-2015 годы выполнено 7096 операций первичного эндопротезирования коленных суставов. В 2157 (30,4%) случаях был диагностирован требующий замещения костный дефект как бедренной, так и большеберцовой кости [14].
С целью восстановления биомеханики коленного сустава и создания долговременной надежной опоры для компонентов эндопротеза у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI, нами разработан и внедрен в клиническую практику способ аутопластики большеберцовой кости при первичном эндопротезировании коленного сустава.
Данная методика выполняется соответственно стандартным этапам эндопротезирования, но имеет некоторые особенности: после выполнения резекции суставной поверхности большеберцовой кости определяется остаточный костный дефицит мыщелка большеберцовой кости. По классификации AORI для аутопластики допускается дефицит не больше T2А. При формирования межмыщелкового бокса бедренной кости производится одновременный забор аутокости. Производится обработка костного аутотрансплантата до придания ему правильной геометрической формы (рис. 1).
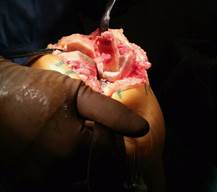
Рис. 1. Забор аутотрансплантата, придание ему правильной геометрической формы
Далее обрабатывается дефект большеберцовой кости до «кровяной росы», после чего в дефекте формируется опорная площадка по размеру трансплантата для плотной посадки аутотрансплантата (рис. 2).
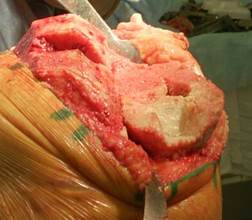
Рис. 2. Обработанный дефект большеберцовой кости со
сформированной опорной площадкой
В последующем аутотрансплантат устанавливается в сформированное ложе и производится импакция до фиксации (рис. 3).
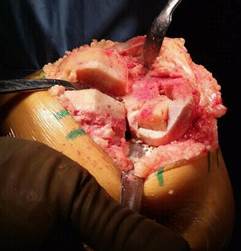
Рис. 3. Импакция аутотрансплантата в сформированном ложе
Дальнейший ход операции соответствует стандартным этапам при первичном эндопротезировании коленного сустава. Восстановительный период не имеет каких-либо особенностей по сравнению со стандартным течением [15].
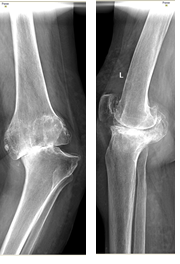
Клинический пример. Пациент С., 65 лет. Диагноз: левосторонний посттравматический гонартроз 3 степени. Дефект медиального мыщелка левой большеберцовой кости. Варусная деформация левой нижней конечности. Комбинированная контрактура левого коленного сустава. Синдром левосторонней гоналгии (рис. 4).

Рис. 4. Рентгенограмма коленного сустава в прямой и боковой проекциях
Пациенту проведено оперативное лечение: эндопротезирование левого коленного сустава с аутопластикой медиального мыщелка большеберцовой кости. Послеоперационный период протекал без особенностей, пациенту была проведена стандартная реабилитация.
На контрольных осмотрах через 6 месяцев, 1 и 2 года после проведенного хирургического лечения пациент отметил хороший результат проведенного лечения, выражающийся в увеличении объема движений в коленном суставе, повышении его стабильности и восстановлении нормальной оси конечности. На контрольной рентгенограмме коленного сустава через 2 года после операции аутотрансплантат состоятелен (рис. 5).
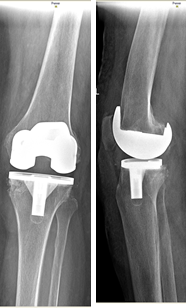
Рис. 5. Контрольная рентгенограмма коленного сустава в прямой и
боковой проекциях через 2 года после операции
Заключение
Таким образом, у пациентов, имеющих костный дефект большеберцовой кости 2А по AORI, при первичном эндопротезировании коленного сустава выполнение аутопластики по разработанной методике приводит к хорошим результатам, выражающимся в создании долговременной надежной опоры для компонентов эндопротеза, что увеличивает срок его службы за счет нормализации распределения нагрузок в прооперированном коленном суставе.
Выводы
1. При первичном эндопротезировании коленного сустава максимальное сохранение костной ткани облегчает хирургическую тактику при последующих хирургических вмешательствах, что очень важно у молодых пациентов.
2. Метод аутопластики является «золотым стандартом» для сохранения костной массы.
3. Аутопластика должна выполняться при отсутствии противопоказаний.
Библиографическая ссылка
Баитов В.С., Гуражев М.Б., Прохоренко В.М. АУТОПЛАСТИКА КОСТНОГО ДЕФЕКТА БОЛЬШЕБЕРЦОВОЙ КОСТИ ПРИ ПЕРВИЧНОМ ЭНДОПРОТЕЗИРОВАНИИ КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. – 2017. – № 6.;
URL: https://science-education.ru/ru/article/view?id=27111 (дата обращения: 23.08.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Пятилетний опыт применения мозаичной костно-хрящевой аутопластики при лечении локальных глубоких повреждений хряща коленного сустава
Часто встречаемые в клинической практике ограниченные по площади повреждения хряща коленного сустава приводят к стойкому и длительному нарушению функции сустава, раннему развитию гонартроза. При поверхностных повреждениях в пределах хрящевой ткани артроскопическая резекция нестабильных фрагментов хряща (шейвинг) приводит к хорошим отдаленным результатам. Одним из наиболее перспективных способов лечения полнослойных дефектов суставного хряща, сопровождающихся обнажением субхондралыюй кости и возникающих к результате рассекающего остеохондрита, остеохондральных переломов и хондромаляция IV степени, является мозаичная костно-хрящевая аутопластика (МКХА), позволяющая восстановить конгруентность суставной поверхности и добиться замещения ее дефекта хрящом, по свойствам сходным с гиалиновым.
В ходе операции в области дефекта суставной поверхности фрезами формируем цилиндрические лунки глубиной 15-20 мм и в них пересаживаем костно-хрящевые аутотрансплантаты соответствующего диаметра и высоты, взятые с менее нагружаемой части наружного или внутреннего мыщелков бедренной кости или межмыщелковой ямки кпереди от места прикрепления крестообразных связок. Небольшое различие диаметров фрез для рассверливания и забора трансплантатов обеспечивает прессфит пересаженных аутотрансплантатов, не требуя дополнительной фиксации.
В послеоперационном периоде пациентам парентерально вводим антибиотики широкого спектра действия и аналгетики. Продолжительность иммобилизации (2-4 недели) зависит от количества пересаженных аутотрансплантатов и стабильности их фиксации. Дозированную нагрузку рекомендуем через 4-6 недель.
После окончания иммобилизации проводим комплексное реабилитационное лечение, включающее лечебную физкультуру, направленную на укрепление мышц конечности и восстановление амплитуды движений в суставе, массаж, водные и физиотерапевтические процедуры. Полную нагрузку разрешаем через 7-8 недель после операции. В течение 2-3 месяцев пациентам рекомендуем при ходьбе пользоваться тростью, сустав фиксировать эластическим бинтом или наколенником.
За пятилетний период операция мозаичной костно-хрящевой аутопластики выполнена нами у 40 пациентов как при изолированных глубоких повреждениях хряща коленного сустава, так и в сочетании их с патологией других внутрисуставных структур: в 25 (62,5%) наблюдениях при рассекающем остеохондрите, в 10 (25%) — при хондральном переломе, в 3 (7,5%) — при остехондральном переломе и у 2 (5%) больных при хондромаляции IV степени. В 7 (17,5%) наблюдениях восстановление конгруентности суставной поверхности сочеталось с ауто- или аллопластикой передней крестообразной связки, у двух (5%) больных с вмешательством на менисках и у одного пациента выполнена корригирующая вальгизирующая остетомия большеберцовой кости для разгрузки внутреннего отдела бедренно-большеберцового сустава.
В ходе операций во всех наблюдениях удалось восстановить конгруентность суставной поверхности, стабильно фиксировать аутотрансплантаты. Непосредственные исходы операций изучены у всех 40 больных — инфекционных и других осложнений не наблюдали.
Отдаленные результаты мозаичной костно-хрящевой аутопластики при продолжительности наблюдений от 36 до 60 месяцев (в среднем — 46,2 месяцев) изучены у 29 (72,5%) пациентов. По данным рентгенологического исследования наступило сращение трансплантатов, в области пересадки суставные поверхности были конгруентными, признаков гонартроза не было. Эти результаты подтверждены данными магнитно-резоненсной томографии, выполненной 15 пациентам в различные сроки после операции. Легкие непостоянные боли в оперированном суставе после тяжелой физической нагрузки при полном функциональном восстановлении и начальные признаки гонартроза в виде субхондрального склероза возникли у трех (10,3%) пациентов, которым выполнена пересадка 4-6 трансплантатов.
Трем пациентам через 6-8 месяцев после операции выполнялась артроскопия, подтвердившая восстановление суставной поверхности в зоне трансплантации, при этом сохранялись очертания контуров трансплантатов и поверхностная фибрилляция хряща, а в местах забора аутотрансплантатов суставная поверхность к этому времени была представлена соединительной тканью.
Наш пятилетний опыт клинического применения мозаичной костно-хрящевой аутопластики убеждает в высокой эффективности этой операции и необходимости ее широкого клинического использования.
Куляба Т.А., Корнилов Н.Н., Новоселов К.А.
ФГУ «РНИИТО им. P.P. Вредена Росздрава», г. Санкт-Петербург
Опубликовал Константин Моканов
Источник
