Эндопротезирование тазобедренного сустава вертлужная впадина
В случае ревизионной артропластики тазобедренного сустава, когда уже имеются значительные костные дефектывертлужной впадины, не всегда представляется возможным использовать обычную ауто- и аллоостеопластику. Одной из причин этого является значительная потеря костной ткани вокруг первично установленного эндопротеза. Первоначально остеолиз может наблюдаться уже вокруг установленного эндопротеза. Процесс значительно прогрессирует в случае инфекционных осложнений, а также если имеются ошибки первичного эндопротезирования, ведущие к нарушению биомеханики установленного сустава и раннему проявлению его нестабильности.
Для фиксации компонентов эндопротеза и закрытия образовавшихся дефектов кости может производиться забор собственной кости больного, например из тазовой кости, и установка его взамен разрушенной кости. Но данный метод требует дополнительных разрезов, что повышает травматичность операций, самого аутоматериала зачастую просто недостаточно для проведения операции, а установленные трансплантаты, лишенные питающих сосудов, могут подвергаться лизису, особенно после гнойных осложнений.
Поставленную задачу можно также решать путем аллоостеопластики (деминерализованные, декальцинированные, структурные и неструктурные костные аллотрансплантаты). Однако в этом случае приходится рассчитывать лишь на их остеокондуктивные свойства, которые в отсутствие питающих сосудов в значительной степени ослабевают при увеличении размера трансплантата более 1,2 см.
Существуют и различные искусственные (металлические) конструкции, формирующие вертлужную впадину. Но использование их носит ограниченный характер вследствие отсутствия индивидуальности, дополнительной травматичности при установке, а также невозможности применения в случаях обширных костных дефектов.
Результатом многочисленных испытаний различных способов решения этой проблемы в ситуациях с дефектами вертлужной впадины от 2В типа по W. G. Paprosky (1991) стала разработка метода закрытия дефекта стенки вертлужной впадины при помощи аутотрансплантата из большого вертела бедренной кости на питающей ножке в целях создания во впадине надежного костного ложа для установки вертлужного компонента эндопротеза.
Разработанный способ осуществлялся следующим образом. После удаления эндопротеза, рубцов, патологических грануляций и выявления дефекта дна вертлужной впадины с целью подготовки к пластике с помощью долота и осцилляторной пилы формировался костный фрагмент из большого вертела на питающей ножке, соответствующий по форме и размеру дефекту вертлужной впадины.
Питающая ножка аутотрансплантата в большинстве случаев выкраивалась из пучков средней и малой ягодичных мышц. Оптимальным являлось формирование питающей ножки из части сухожилия одной мышцы — малой ягодичной, поскольку она лежит в самом глубоком слое и позволяет весьма удобно перенести фрагмент большого вертела в вертлужную впадину без натяжения и перегибов. Однако выделение малой ягодичной мышцы зачастую бывает весьма затруднительно, поэтому обычно для формирования питающей ножки использовали пучки сухожилий двух мышц — малой и средней ягодичных. Соответственно, питание осуществляется за счет ветвей первого порядка верхней ягодичной артерии.
Затем трансплантат перфорировался и временно фиксировался к своему ложу. Для адаптации регенерата к новым условиям кровоснабжения рана ушивалась на 3-4 недели.
На втором этапе, после обработки дефекта вертлужной впадины, подготовленный аутотрансплантат перемещали на питающей ножке, укладывали во впадину таким образом, чтобы максимально закрыть дефект, и фиксировали его при помощи 2-3 винтов. Далее впадина обрабатывалась для установки вертлужного компонента эндопротеза, причем в некоторых случаях возникала необходимость использования укрепляющих колец (Мюллера, Ганса) или антипротрузионной системы (Бурх — Шнайдера).
По описанному и запатентованному способу было прооперировано 12 больных с различными дефектами вертлужной впадины. Сроки наблюдения после операции составили от 1 до 7 лет. У 91,9 % + 1,3 % пациентов получены хорошие и отличные результаты (от 84 до 93 баллов по шкале Харриса) — отмечена желаемая функциональная перестройка остеотрансплантатов, вертлужные компоненты эндопротезов за все время наблюдения остаются стабильными, отсутствует их дислокация, больные не жалуются на боли, движения в оперированных суставах не ограничены, ходят без помощи костылей и трости.
В. К. Николенко, Б. П. Буряченко, Д. В. Давыдов
ФГУ «Главный военный клинический госпиталь им. академика Н. Н. Бурденко МО РФ», Государственный институт усовершенствования врачей МО РФ, г. Москва
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Пронских А.А.
1
Харитонов К.Н.
1
Кузин В.Ю.
1
Ефименко М.В.
1
Голенков О.И.
2
Павлов В.В.
1
1 ФГБУ «Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна» Минздрава России
2 ФГБУ Новосибирский научно-исследовательский институт травматологии и ортопедии им. Я.Л. Цивьяна Минздрава России
Целью данного исследования явилась оценка результатов лечения пациентов с посттравматическим коксартрозом 3 стадии в сочетании с дефектами вертлужной впадины. За 2012-2018 гг. в клинике ННИИТО был пролечен 221 пациент, которые были разделены на 2 группы: в I группу включены 189 пациентов, которым оперативное лечение по поводу перелома вертлужной впадины либо не проводилось, либо суставная поверхность не была восстановлена, либо операция была выполнена в срок более 21 дня с момента травмы. В II группу включены 32 пациента, которым в срок до 21 дня с момента травмы был проведен стабильный остеосинтез с восстановлением суставной поверхности вертлужной впадины. Всем пациентам было проведено тотальное эндопротезирование тазобедренного сустава. При анализе результатов было выявлено, что у пациентов II группы посттравматический коксартроз 3 стадии развивался позже в среднем на 2,6 года, дефекты костной ткани вертлужной впадины III a и обширнее по классификации W.G. Paprosky встречались на 32% реже, что позволило провести более рутинное первичное эндопротезирование тазобедренного сустава без использования индивидуальных конструкций, уменьшить продолжительность стационарного лечения на 19,5 койко-дней и снизить количество осложнений на 11%.
перелом вертлужной впадины
посттравматический коксартроз
эндопротезирование
дефект костной ткани
индивидуальный аугмент
1. Гринь А.А., Рунков А.В., Шлыков И.Л. Выбор операционного доступа при лечении двухколонных переломов вертлужной впадины // Травматология и ортопедия России. 2014. № 1 (71). С. 92-97.
2. Laird A., Keatig J.E. Acetabular fractures. A 16-year prospective epidemiological study. J. Bone Joint Surg. 2005. V. 87B (7). Р. 969-973.
3. Лазарев А.Ф., Солод Э.И., Гудушаури Я.Г., Кабадзе М.Г., Стоюхин М.Г., Сахарных И.Н. Проблемы лечения переломов вертлужной впадины // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2013. № 4. С. 81-85.
4. Бондаренко А.В., Круглыхин И.В., Плотников И.А., Войтенко А.Н., Жмурков О.А. Особенности лечения повреждений таза при политравме // Политравма. 2014. № 3. С. 46-57.
5. Чегуров О.К., Менщиков И.Н. Лечение повреждений вертлужной впадины и их последствий (обзор литературы) // Гений ортопедии. 2018. Т. 24. № 1. С. 95-101. DOI: 10.18019/1028-4427-2018-24-1-95-101.
6. Малютин А.П., Норкин И.А. Тактика эндопротезирования тазобедренного сустава при дефектах вертлужной впадины // Саратовский научно-медицинский журнал. 2008. Т. 4, № 4. С. 83–88.
7. Giannoudis P.V., Grotz M.R., Papakistidis P., Dinopoulus H. Operative treatment of displaced fractures of the acetabulum. J. Bone Joint Surg. 2005. 87B (1). Р. 2-9.
8. Ranawat A., et al. Total hip arthroplasty for posttraumatic arthritis after acetabular fracture Arthroplasty. 2009. Vol. 24, N 5. P. 759–767.
9. Тихилов Р.М., Шубняков И.И., Чиладзе И.Т., Плиев Д.Г., Шорустамов М.Т., Артюх В.А., Амбросенков А.В., Близнюков В.В., Мясоедов А.А. Выбор способа имплантации вертлужного компонента на основе рабочей классификации последствий переломов вертлужной впадины // Травматология и ортопедия России. 2011. № 2. С. 37–43.
10. Чегуров О.К., Менщиков И.Н., Жданов А.С. Реконструктивное эндопротезирование тазобедренного сустава у больной с последствием повреждений вертлужной впадины (случай из практики) // Гений ортопедии. 2017. Т. 23. № 3. С. 364-367.
11. Коваленко А.Н., Шубняков И.И., Билык С.С., Тихилов Р.М. Современные технологии лечения тяжелых костных дефектов в области вертлужной впадины: какие проблемы решают индивидуальные имплантаты? // Политравма. 2017. №1. С.72-81.
12. Amirouche F., Solitro G.F., Walia A., Gonzalez M., Bobko A. Segmental acetabular rim defects, bone loss, oversizing, and press fit cup in total hip arthroplasty evaluated with a probabilistic finite element analysis. Int. Orthop. 2017. V. 41(8). Р. 1527-1533. DOI: 10.1007/s00264-016-3369-y.
Переломы вертлужной впадины составляют от 7% до 25% от повреждений таза [1]. Частота встречаемости подобной патологии составляет 3 случая на 100 000 населения в год [2]. За последние 100 лет, в связи с ростом количества ДТП, их количество увеличилось в 20 раз. Последствия подобных травм значительно снижают качество жизни и являются причиной стойкой утраты трудоспособности. Несмотря на успехи современной травматологии, разработку новых алгоритмов и методов оперативного лечения, устройств для остеосинтеза и способов их применения, по данным современной литературы можно сделать заключение, что даже проведение стабильного остеосинтеза с анатомическим восстановлением суставной поверхности вертлужной впадины в раннем посттравматическом периоде не гарантирует удовлетворительного результата [3; 4].
Дегенеративно-дистрофические изменения тазобедренного сустава, требующие хирургического лечения, развиваются у 12-88% пострадавших [1; 2; 5]. При развитии посттравматического коксартроза возможности оперативного лечения ограничены артродезированием и эндопротезированием тазобедренного сустава. Формирование анкилоза тазобедренного сустава приводит к нарушению не только позвоночно-тазовых отношений, но механических осей дистальных суставов нижних конечностей, что приводит к развитию гонартрозов и крузартрозов, значительному нарушению походки, снижению качества жизни. В связи с этим наиболее предпочтительным способом хирургического лечения является тотальное эндопротезирование тазобедренного сустава [6; 7]. Однако, несмотря на широкое использование данной методики, результаты лечения посттравматического коксартроза хуже, чем при лечении идиопатического коксартроза [2; 8; 9]. К основным сложностям, с которыми сталкивается хирург в ситуации лечения посттравматического коксартроза, в первую очередь относятся дефекты костной ткани вертлужной впадины, не позволяющие достичь прочной первичной фиксации стандартных вертлужных компонентов. В тех случаях, когда перелом вертлужной впадины сросся, высока вероятность порочной консолидации отломков, что приводит к нарушению анатомических взаимоотношений в суставе. Предшествующие многократные и объемные операции приводят к наличию выраженного мягкотканного рубцового процесса не только в проекции доступа, но и в области параартикулярных тканей, что увеличивает время оперативного вмешательства, снижает реабилитационный потенциал, повышает риск септических осложнений. Наличие металлоконструкций также ограничивает варианты использования имплантатов, увеличивает риск развития параимплантной инфекции, при необходимости удаления металлоконструкций увеличивается тяжесть интраоперационного травматического воздействия. Вследствие выраженного изменения анатомических осложнений у пациентов с посттравматическим коксартрозом определяется сформированный порочный мышечный стереотип ходьбы, что также снижает реабилитационный потенциал. Асептический некроз головки бедренной кости, развившийся вследствие перенесенной травмы, ограничивает возможность замещения посттравматических дефектов путем аутоостеопластики [1; 10]. Выбор метода оперативного лечения зависит от величины костных дефектов, качества костной ткани, наличия интактных колонн вертлужной впадины или нарушенной целостности тазового кольца, что определяет возможность обеспечения надежной фиксации и достаточной площади контакта с жизнеспособной костью [11].
Цель исследования: оценить результаты лечения пациентов с посттравматическим коксартрозом 3 стадии в сочетании с дефектами вертлужной впадины.
Материал и методы исследования. За 2012-2018 гг. в ННИИТО был пролечен 221 пациент с коксартрозом 3 стадии и посттравматическими дефектами вертлужной впадины. Учитывая отсутствие общепринятой классификации посттравматических дефектов вертлужной впадины, оценку дефектов мы проводили по одной из самых распространенных и наиболее цитируемой в современной литературе – классификации W.G. Paprosky. Выбор данной классификации был обусловлен не только ее распространенностью, но и относительной универсальностью, которая позволяет использовать данную классификацию для оценки дефектов любой этиологии и определить тактику оперативного лечения согласно алгоритму, предложенному авторами [12]. При проведении анализа также учитывали тип перелома вертлужной впадины по классификации АО, способ предшествующего лечения (восстановление суставной поверхности вертлужной впадины, проведение стабильного остеосинтеза, сроки проведения оперативного вмешательства), срок, прошедший после травмы до проведения эндопротезирования, тип дефекта по классификации W.G. Paprosky. Критериями включения в исследование были следующие параметры: возраст старше 18 лет, наличие посттравматического коксартроза 3 стадии и дефекта вертлужной впадины IIa и обширнее по классификации W.G. Paprosky. Критерием исключения являлись пациенты младше 18 лет, а также пациенты с наличием хронического инфекционного процесса в области тазобедренного сустава. Пациенты были разделены на 2 группы: в I группу включены 189 пациентов, которым оперативное лечение по поводу перелома вертлужной впадины либо не проводилось, либо суставная поверхность не была восстановлена, либо операция была выполнена в срок более 21 дня с момента травмы. Во II группу включены 32 пациента, которым в срок до 21 дня с момента травмы был проведен стабильный остеосинтез с восстановлением суставной поверхности вертлужной впадины.
Половой состав групп был неоднороден, в обеих группах преобладало количество мужчин – соотношение женщины/мужчины: 1 к 5.
В I группе было 46 женщин и 143 мужчины, средний возраст составил 49+1 год (min 24, max 78, медиана 51), во II группе 4 женщины и 28 мужчин, средний возраст составил 50+2 года (min 28, max 79, медиана 53).
При анализе типа и характера переломов вертлужной впадины было выявлено, что в группе I чаще всего были диагностированы переломы типа A, а в группе II – чаще всего встречались переломы типа B по классификации AO (табл. 1).
Таблица 1
Распределение пациентов в группах по типу перелома по шкале AO ASIF
Тип перелома | A | B | C |
Группа I (n=189) | 52% (99 случаев) | 42% (79 случаев) | 6% (11 случаев) |
Группа II (n=32) | 19% (6 случаев) | 62% (20 случаев) | 19% (6 случаев) |
Диагностированные при поступлении посттравматические дефекты в I группе были обширнее, преобладали дефекты с повреждением заднего края вертлужной впадины, в группе II дефекты были менее обширными, дефектов с нарушением целостности тазового кольца выявлено не было (табл. 2).
Таблица 2
Распределение пациентов в группах по типу посттравматического дефекта по классификации W.G. Paprosky
Тип дефекта | IIa | IIb | IIc | IIIa | IIIb | Pelvic discontinuity |
Группа I (n=189) | 14% (n=26) | 25% (n=47) | 24% (n=45) | 15% (n=28) | 15% (n=29) | 7% (n=14) |
Группа II (n=32) | 44% (n=14) | 33% (n=10) | 8% (n=3) | 15% (n=5) |
При выполнении эндопротезирования ориентировались на характер дефекта и плотность опороспособной костной ткани. Выполнение только рентгенографии, даже в дополнительных проекциях, не позволяет достоверно оценить степень и характер дефектов вертлужной впадины [13]. Для этого всем пациентам проводили МСКТ таза, полученные данные конвертировали в 3D-модель. Для моделирования дефекта и измененной анатомии вертлужной впадины использовали метод индивидуальной контурной пластики с оценкой плотности костной ткани по шкале Хаунсфилда. Разработанная методика подразумевает проведение нескольких последовательных этапов, в результате которых оцениваются данные об истинной геометрии дефекта и плотности костной ткани. Оценивая полученную информацию, моделируется геометрия, пространственное положение, опорная поверхность с учетом опороспособной кости. При имплантации использовали компоненты press-fit фиксации, для достижения первичной биологической фиксации, при необходимости, вертлужные компоненты дополнительно фиксировались винтами. Для минимизации травматичности вмешательства, уменьшения интраоперационной кровопотери и времени оперативного вмешательства, во всех случаях, мы старались выполнить как можно более «рутинное» эндопротезирование. По данным термином мы понимаем минимально возможный оперативный доступ, при наличии металлоконструкций, винты и пластины удаляли только в случаях, когда они мешали имплантации компонентов эндопротеза либо проведению фиксирующих винтов. Для удаления металлоконструкций специальных доступов не применялось. Компоненты цементной фиксации и антипротрузионные кольца не использовались, так как во всех случаях мы стремились добиться не только прочности, но и биологичности первичной фиксации. Для замещения дефектов использовали опорные аугменты различных форм из пористого титана, проводили костную аутопластику из головки бедренной кости, костную стружку, полученную при обработке ацетабулярной впадины фрезами. В случае неудовлетворительного качества костной ткани головки бедренной кости либо при объеме дефекта, превышающем возможности имеющейся аутокости, применяли аллопластику с использованием как депротеинизированной костной ткани, так и структурных донорских трансплантатов. В I группе в 14 случаях были использованы индивидуальные вертлужные компоненты, напечатанные на 3D-принтере. Индивидуальными конструкциями мы пользовались в случаях, когда геометрия дефекта вертлужной впадины не позволяла заместить его с помощью стандартных конструкций, либо если направление винтов стандартных заводских конструкций не позволило бы добиться прочной фиксации имплантатов.
Результаты исследования и их обсуждение. При анализе срока, прошедшего со времени получения травмы до обращения в клинику эндопротезирования по поводу выраженного деформирующего остеоартроза, было выявлено, что развитие посттравматического коксартроза 3 стадии в I группе наступало статистически достоверно быстрее, чем во II группе (табл. 3).
Таблица 3
Срок развития посттравматического коксартроза 3 стадии
Наименование группы | Срок в годах | Min | Max | Медиана |
Группа I (n=189) | 5,2+0,6 | 1 | 40 | 2 |
Группа II (n=32) | 7,8+1,7 | 1 | 21 | 5 |
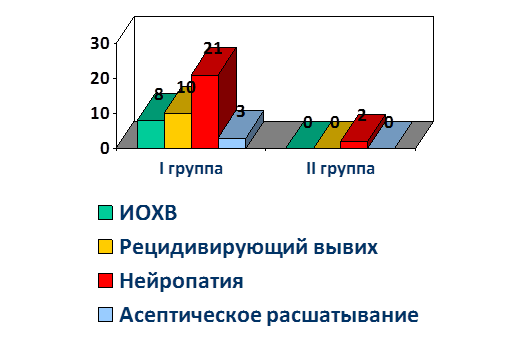
Среднее время операции в I группе 81+3 минуты, кровопотеря 314+36 мл, во II группе кровопотеря 300+24 мл, среднее время операции 75+16 минут. Данные показатели в обеих группах статистически значимо не различались ввиду выполнения оперативных вмешательств одними и теми же хирургами, с использованием идентичного предоперационного планирования и хирургической тактики. Однако средний срок продолжительности стационарного лечения в I группе составил 27,7+16 койко-дня, медиана – 18,8; а во II группе 8,2+0,3 койко-дня, медиана – 8 койко-дней. Данные показатели были связаны с длительным предоперационным периодом вследствие изготовления индивидуальных конструкций, а также с тем, что у пациентов первой группы реабилитационный потенциал был ниже, что потребовало более продолжительного послеоперационного восстановления. Процент осложнений в I группе составил 17% (32 случая), во II группе 6% (2 случая) (рисунок).
При анализе осложнений было выявлено, что наиболее часто встречаемым осложнением являлись нейропатии различных порций седалищного нерва. Столь большое количество связано с тем, что мы учитывали как вновь возникшие нейропатии (6 случаев в I группе), так и рецидивы уже имеющихся неврологических нарушений (17 случаев в обеих группах). Согласно данным проведенных нейрофизиологических исследований, не было выявлено ни одного случая интраоперационного анатомического перерыва седалищного нерва. На фоне проводимой медикаментозной нейропротекторной терапии, физиолечения, лечебной физкультуры в течение 6 месяцев все неврологические нарушения были купированы, необратимых изменений выявлено не было. На втором месте по частоте встречаемости находились вывихи бедренного компонента, связанные с нарушением мышечного баланса и патологическим стереотипом ходьбы у пациентов I группы. Данный вид осложнений возникал до 2015 г., так как с этого периода в нашей клинике были внедрены методики баланс-тренинга и использование вертлужных компонентов с двойной мобильностью.
Количество инфекционных осложнений – как ранних (3 случая), так и поздних (5 случаев), коррелирует с цифрами, приводимыми в современной мировой литературе.

Структура послеоперационных осложнений
Отдаленные результаты от 6 до 27 месяцев отслежены у 182 пациентов – у 153 пациентов I группы и у 25 пациентов II группы. В I группе через 6 месяцев уровень функции сустава по шкале Харриса составил 80,7+17,2, во II группе 83,25+18,6 балла. Ревизионное эндопротезирование в раннем и отдаленном периоде понадобилось 21 пациенту I группы: 10 — по причине рецидивирующего вывиха бедренного компонента (проводилась замена пары трения, замена вертлужного компонента на компонент с двойной мобильностью – 7 человек, и различные варианты миопластики – 3 случая); 8 — по причине глубокой парапротезной инфекции – проведены двухэтапные реэндопротезирования, в течение сроков наблюдения, рецидивов инфекционного процесса выявлено не было. 3 пациентам I группы понадобилось реэндопротезирование по поводу раннего асептического расшатывания компонентов. 2 пациентам проведена замена вертлужного компонента, в 1 случае расшатывание было тотальным. Во II группе ревизионных вмешательств не потребовалось.
Заключение. Раннее оперативное восстановление суставной поверхности у пациентов с переломами вертлужной впадины позволяет замедлить скорость развития посттравматического коксартроза, уменьшает риск развития массивного дефекта вертлужной впадины, что позволяет провести более рутинное первичное эндопротезирование тазобедренного сустава без использования индивидуальных конструкций, уменьшить продолжительность стационарного лечения и снизить количество осложнений. Наиболее часто встречаемым осложнением является рецидив неврологических нарушений, что требует от хирурга проведения тщательного предоперационного планирования, щадящей хирургической техники и проведения широкого комплекса реабилитационных мероприятий.
Библиографическая ссылка
Пронских А.А., Харитонов К.Н., Кузин В.Ю., Ефименко М.В., Голенков О.И., Павлов В.В. ЭНДОПРОТЕЗИРОВАНИЕ ТАЗОБЕДРЕННОГО СУСТАВА У ПАЦИЕНТОВ С ОБШИРНЫМИ ПОСТТРАВМАТИЧЕСКИМИ ДЕФЕКТАМИ ВЕРТЛУЖНОЙ ВПАДИНЫ // Современные проблемы науки и образования. – 2019. – № 5.;
URL: https://science-education.ru/ru/article/view?id=29253 (дата обращения: 07.07.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
