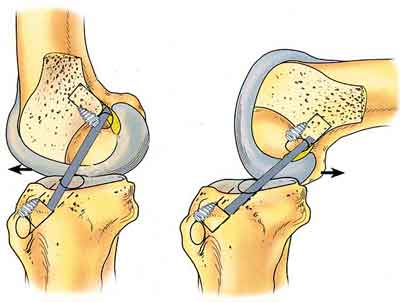
Циклоп синдром коленного сустава
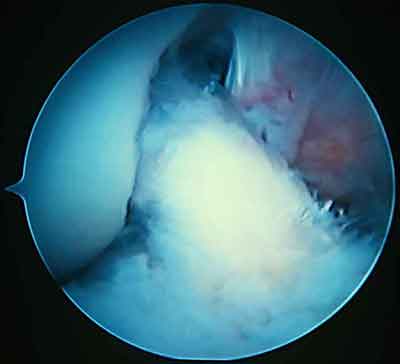
Циклоп-синдром – это осложнение после пластики передней крестообразной связки, возникающее вследствие рубцевания трансплантата в межмыщелковом пространстве.
Этиология
При пластике ПКС трансплантатом из собственной связки надколенника (техника ВТВ) трансплантат значительно утолщается в результате ремоделирования и рубцовых процессов. Возникновению циклоп-синдрома способствуют следующие факторы:
- Переднее расположение большеберцового канала при пластике ПКС,
- Невозможность достижения полного разгибания в раннем послеоперационном периоде,
- Нотч-пластика (не подтверждено).
Значительно реже циклоп-синдром возникает после пластики ПКС с использованием сухожилия полусухожильной мышцы. В этом случае причиной является рубцевание дистальной культи ПКС, сохранённой в ходе операции.
Клиническая картина
Ведущий симптом – ограничение разгибания в коленном суставе, которое может быть постоянным или периодическим. Пациенты часто отмечают улучшение разгибания во время лечебной гимнастики, однако спустя примерно час объем движений возвращается к исходному уровню. Также может появится непостоянный блок в коленном суставе, вызванный разрывом мениска.
Доминирующим симптомом у пациентов с минимальным ограничением разгибания может стать боль в области бедренно-надколенникового сустава.
Диагностика
Основную диагностическую ценность имеют сбор анамнеза и клинический осмотр. Ограничение разгибания имеет пружинящую конечную точку.
Специфические клинические тесты для диагностики циклоп-синдрома отсутствуют. Тест Лахмана следует проводить во всех случаях. Наличие циклоп-синдрома не означает послеоперационной стабильности.
Для оценки большеберцового канала можно выполнить рентгенографию в боковой проекции. Рекомендовано также исследование в боковой проекции под нагрузкой в положении Лахмана (30° сгибания) или в положении максимального разгибания, выполняемое с целью документации. Переднее положение большеберцового канала легко определяется.
Чем более кпереди сформирован большеберцовый канал, тем выше вероятность развития симптоматичного рубцевания трансплантата ПКС.
По данным МРТ можно определить положение большеберцового канала (сформирован ли слишком кпереди) и наличие рубцовой ткани кпереди от ПКС, обычно имеющей образования с низкой интенсивностью сигнала.
У пациентов с характерным анамнезом и послеоперационным ограничением разгибания диагноз считается установленным, поэтому выполнение МРТ нецелесообразно.
Артроскопические данные
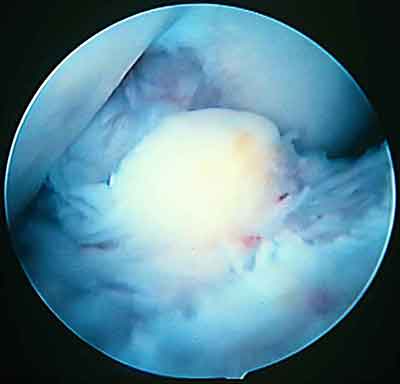
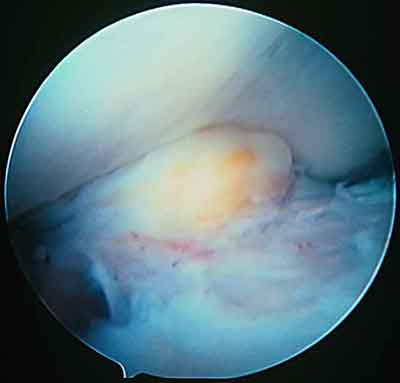
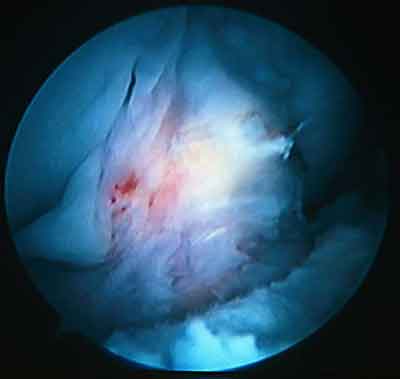
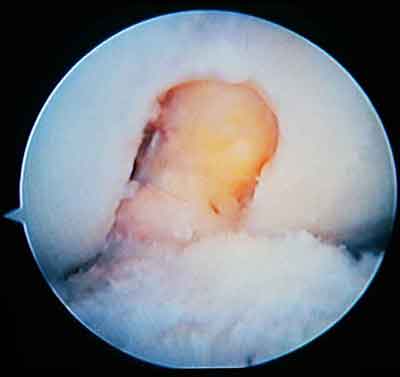
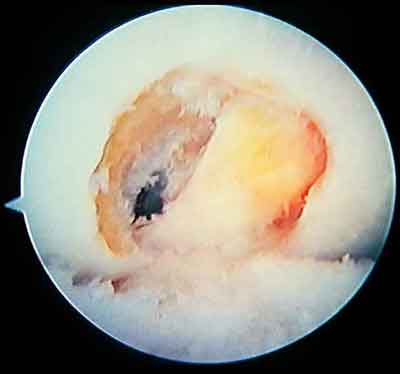
При ревизии межмыщелкового пространства определяются узелки рубцовой ткани разных размеров. При попеременном сгибании и разгибании видно, как рубцовая ткань собирается между мыщелками бедренной и большеберцовой костей, создавая препятствие для полного разгибания.
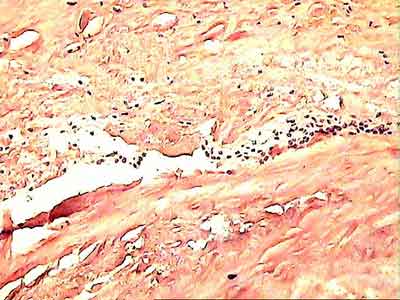
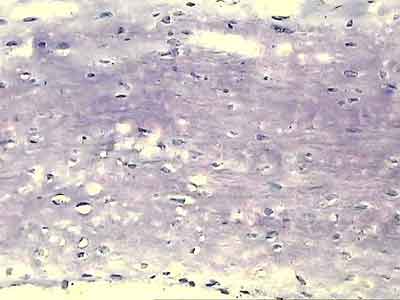
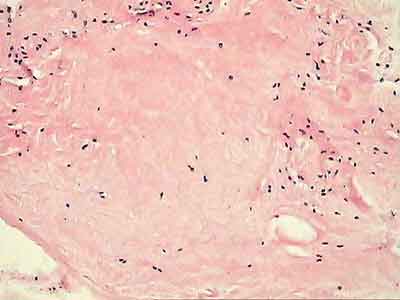
Внешний вид рубцовой ткани различен. Нередко можно обнаружить объёмную однородную рубцовую массу, расположенную дистальнее трансплантата ПКС. В некоторых случаях рубцовая ткань пигментирована и состоит из множества образований меньших размеров. Как правило, в рубцовой ткани отмечаются голубоватые или багровые участки кровоизлияний, возникающих вследствие постоянной микротравматизации. Для рубцовой ткани характерна волокнистая структура, что требует её дифференцировки от волокон трансплантата.
Размеры волокнистого узелка различны, их диаметр может варьировать от 5 мм до 2-4 см и даже более.
Лечение
Консервативные методы лечения отсутствуют. Даже интенсивное восстановительное лечение не уменьшит ограничения разгибания.
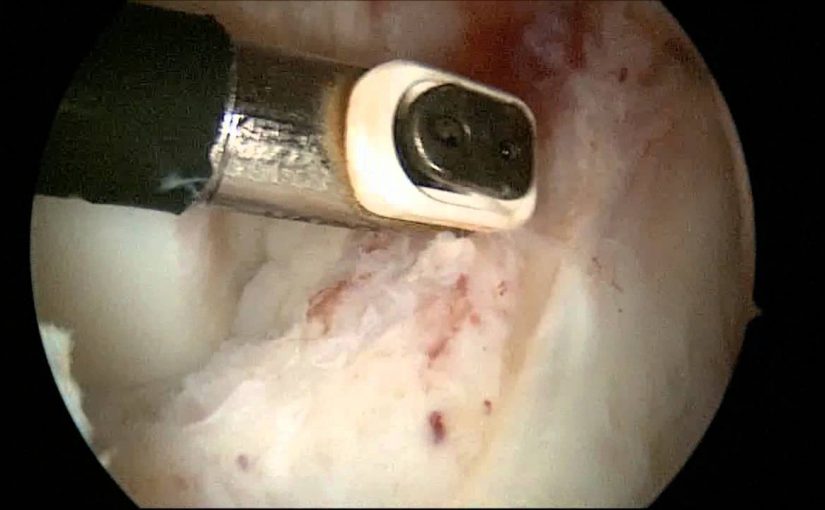
Единственно эффективный метод лечения – артроскопическое иссечение рубцовой ткани, что в большинстве случаев приводит к полному восстановлению объёма движений. У большинства пациентов полное разгибание в коленном суставе возможно сразу после оперативного вмешательства. У остальных полный объем движений восстанавливается только после реабилитационной терапии, направленной на растяжение задней капсулы.
Если после реабилитационной терапии объем разгибания не восстановлен полностью, следует исключить фиброз задней капсулы, например, в случае её повреждения во время первичной травмы и недостигнутого полного разгибания в раннем реабилитационном периоде, либо в тех случаях, когда первичная пластика ПКС была выполнена в остром периоде травмы.
Техника операции
- Ревизия.
- Пальпация щупом.
- Резекция рубцовой ткани.
- Извлечение рубца.
- Очищение трансплантата от оставшейся рубцовой ткани.
- Тест на импиджмент.
- Мобилизация.
- Гемостаз.
Послеоперационное ведение
После операции конечность помещается в ортез для сохранения разгибания и растяжения задней части капсулы. Гиперэкстензионные ортезы, 0° ортезы и этапные гипсовые повязки очень болезненны для некоторых пациентов и являются препятствием для реабилитационной терапии.
Есть сведения о хороших результатах, достигнутых при использовании ортезов, поддерживающих задние отделы сустава (PTS splint), которые используются при повреждениях ЗКС. Смещая большеберцовую кость кпереди по отношению к бедру, ортез помогает растянуть заднюю часть капсулы. Это переносится лучше, чем растяжение капсулы принудительным разгибанием.
Интенсивное восстановительное лечение начинается после удаления дренажа в первый послеоперационный день. При значительном и долговременном ограничении разгибания рекомендуется стационарное лечение в отделении реабилитации.
Консультирование
Пациент должен быть информирован о возможном рецидиве циклоп-синдрома, требующем повторного хирургического вмешательства.
Источник
Осложнения и их коррекция после артроскопической статической стабилизации коленного сустава аутотрансплантатом кость-сухожилие-кость
Цель исследования — выявить наиболее частые причины неудовлетворительных результатов оперативного лечения после статической стабилизации коленного сустава аутотрансплантатом «кость-сухожилие-кость».
В клинике спортивной и балетной травмы ЦИТО с 1995 по 2005г по поводу артроскопической статической стабилизации коленного сустава после повреждения ПКС было прооперировано 465 человек. Из них 168 женщин и 298 мужчин. Среди пациентов преобладали спортсмены и артисты балета (78%). Ревизионным операциям подверглись 32 пациента. Выполняя статические операции на коленном суставе наиболее важным моментом являются различные технические погрешности, причиной неудовлетворительных результатов которых в послеоперационном периоде может быть следующее:
1. Расположение бедренного туннеля кпереди от изометрической зоны приводит к удлинению трансплантата при сгибании сустава. Если же он отнесен кзади, то наоборот, удлинение происходит при разгибании, что ведет к его функциональной неполноценности.
Так, в 8 случаях у наших пациентов, выполняя ревизионную артроскопию, мы наблюдали нарушение топографии проведения внутрикостных каналов, бедренный туннель был смещен кпереди из-за того, что задняя крестообразная связка заполняла практически всю межмыщелковую вырезку, это не позволяло нам разместить канал в изометрической зоне без травматизации ЗКС. Это осложнение было у нас в начале 90-х, когда мы еще не резецировали внутреннюю поверхность наружного мыщелка бедра.
2. Неправильная тактика ведения больных после артроскопической пластики ПКС может привести к таким серьезным осложнениям, как артрофиброз — разрастание соединительно-рубцовой ткани в коленном суставе. С такой патологией мы встретились в 4 случаях, с помощью артроскопической техники мы выполняли лигаментолиз.
3. Циклоп-синдром, характеризующийся ограничением экстензии голени, болью в переднем отделе коленного сустава и обусловленный наличием и дальнейшей организацией внутрисуставной гематомы, образованием рубцово-фиброзной ткани с вовлечением аутотрансплантата в этот процесс. У 9 пациентов нам приходилось частично резецировать аутотрансплантат, это единственный способ увеличить амплитуду движений в суставе.
4. Расположение тибиального туннеля кпереди приводит к импинджмент-синдрому. У 7 пациентов отмечен болезненный щелчок при разгибании, что мы объясняем соударением аутотрансплантата с бугорками межмыщелкого возвышения, при ревизии мы производили «Notch»-пластику и проверяли наличие трения не только при флексии-экстензии, но и при наружной и внутренней ротации.
5. У 4 пациентов спустя 3-4 месяца после операции появились боли в области тибиального интерферентного винта, в такой ситуации мы удаляли винты Kurasaka, это способствовало стиханию болевого синдрома.
Оценка результатов включала 3 степени: хорошую (интегральный показатель выше 4 баллов), удовлетворительную (3-4 балла), неудовлетворительную (ниже 3 баллов). В 345 случаях получен хороший результат лечения, в 96 — удовлетворительный и в 24 — неудовлетворительный.
Проблема совершенствования стабилизирующих операций на коленном суставе остается актуальной. Соблюдая вышеперечисленные погрешности, мы можем снизить процент ревизионных операций.
Тимченко Д.О., Буткова Л.Л., Езеев А.Р., Ефимочкин А.С.
Федеральное государственное учреждение «Центральный институт травматологии и ортопедии им. Н.Н. Приорова», отделение спортивной и балетной травмы
Источник
| Вопросы врачу Советы по гигиене Библиотека Баннерообмен Карта сайта | |||||||||
| |||||||||
Источник