Артроз коленного сустава диссертация
1. Алексеева Л.И. Современные представления о диагностике и лечении остеоартроза. // Русский медицинский журнал. 2000, т.8, N.-9. С. 377-82.
2. Алексеева Л.И. Эпидемиологические основы остеоартроза (OA): методология, распространенность, факторы риска в этнически неоднородных группах населения России и фармакотерапия. // Дисс. доктор, мед. наук. Москва, 2000. С. 198.
3. Астапенко М.Г., Баятова К.В. О клинике и классификации первичного деформирующего остеоартроза. // Тер. архив. 1988, N-4. С. 120-132.
4. Астапенко М.Г. Копьева Т.Н., Фильчагин Н.М. Итоги длительного изучения механизма дегенерации суставного хряща при первичном деформирующем остеоартрозе. // Тер. Архив. 1982, N-6. С. 115-121.
5. Астапенко М.Г., Копьева Т.Н., Дуляпин В.А., Фильчагин Н.М., Мазина М.Н., Баятова К.В. Клинико-лабораторная диагностика синовита при деформирующем остеоартрозе. // Ревматология. 1984, N-2. С. 10-11.
6. Астапенко М.Г., Копьева Т.Н., Мазина Н.М. О механизме деструкции суставного хряща при остеоартрозе. // Тез. XVI симп. Евр. общества ос-теоартрологов: Деструкция суставов. 1987.-5/15.
7. Ахадов Т.А., Панов В.О., У. Айххофф. // Магнитно-резонансная томография спинного мозга и позвоночника. Москва 2000. С. 747.
8. Баев А.А. Магнитно-резонансная томография в ранней диагностике остеоартроза коленного сустава. // Дисс. канд. мед. наук. Обнинск, 2002. С. 133.
9. Беневоленская Л.И., Подчалимова, В.В., Бржезовский М.М. и др. Факторы, способствующие развитию остеоартроза. // Тер. Архив, 1987. N-4. С. 35-38.
10. Брюханов А.В., Васильев А.Ю. Магнитно-резонансная томография в диагностике заболеваний суставов. // Барнаул. 2001. С. 198.
11. П.Гланц С. Медико-биологичекая статистика (перевод с английского). // Москва. 1999. С. 459.
12. Дахи. А. Характеристика реактивного синовита при гонартрозе (клинико-инструментальное сопоставление). Дисс. канд.мед. наук. Москва, 1994. С. 94.
13. Дахи А. Цветкова Е.С., Мач Э.С., и др. Ультразвуковая диагностика синовита при гонартрозе. // Клинич. Ревматология. 1994, N-1. С. 19-22.
14. Дедов И. И., Беленков Ю. Н., Беличенко О.И., Мельниченко Г.А. // Магнитно-резонансная томография в диагностике заболеваний гипопаламо-гипофизарной системы и надпочечников. Москва. 1997. С. 159.
15. Зубарев А.В., Николаев А.П, Долгова И.В., Лазарев А.Ф. Современная ультразвуковая диагностика в травматологии. // Мед. визуализация. 1999. N-1, С. 11-20.
16. Зубарев А.В. Диагностический ультразвук (Костно-мышечная система). Практическое руководство. Москва. 2002.С. 136.
17. Копьева Т.Н., Астапенко М.Г., Арутюнов А.Г. Синовит при остеоартрозе (клинико-морфологическое исследование). // Ревматология. 1988. N 4. С. 47-52.
18. Копьева Т.Н., Веникова М.С. Клиническая морфология артритов при ревматических заболеваниях. // Москва 1992. С.219.
19. Луговец С.Г. Подколенные кисты при ревматических болезнях: диагностика и частота (по данным артросонографии). // Дисс. канд. мед. наук. Москва, 1998. С. 100.
20. Лучихина Л.В., Баев А.А. Соотношение МРТ метода и артроскопии в диагностике остеоартроза. // Тезисы докл. II Всероссийского съезда ревматологов. Тула, 1997.С. 112.
21. Лучихина Л.В. Ранняя диагностика и патогенетическая терапия артроза. // Дисс. докт. мед. наук. Москва, 1998. С. 271.
22. Лучихина JI.B. Артроз. Ранняя диагностика и патогенетическая терапия // М.:НПО «Медицинская энциклопедия». Москва, 2001. С. 167.
23. Марасаев В.В. Роль суставного синдрома в общей картине болезни при ревматодном артрите (клинико-инстументальные сопостоавления, функциональные особенности, тяжесть течения). Дисс. доктор, мед. наук. Ярославль, 1998. С. 264.
24. Мач Э.С., Пушкова О.В. Современные инструментальные методы диагностики остеоартроза. // II Всероссийский съезд ревматологов. Тезисы. Тула. 1997.С. 121.
25. Мовсисян Г.Р. Оценка локального воспаления в коленных суставах у больных ЮРА по данным клиники, УЗТ. // Автореф. канд. мед. наук. М. 1998. С. 22.
26. Насонов E.JI. Интерлейкин-1 и его роль в патологии человека. // Тер архив .1987. N 12. С. 112-117.
27. Насонова В.А., Фоломеева О.М. Медико-социальные проблемы хронических заболеваний суставов и позвоночника. // Тер. архив. 2000. N-5. С. 58.
28. Насонова В.А. Остеоартроз коленного сустава: причины развития, диагностика и профилактика. // Консилиум, 2003, том 5, N-2.C .90-95.
29. Павлова В.Н., Копьева Т.Н., Слуцкий. Л.И., Павлов Г.Г. // Хрящ. М: Медицина. 1998. С. 320.
30. Панасюк Е.Ю. Объективные методы оценки и сравнительная эффективность различных доз гликозаминогликан-полисульфата при гонартрозе. // Канд. дисс.мед. наук. Москва, 1998. С. 116.
31. ЗЬПанасюк Е.Ю., Цветкова Е.С., Олюнин Ю.А., Смирнов А.В. Артроскопия в диагностике гонартроза. // Научно-практич. Ревматология. 2000. N-2. С. 12-17.
32. Фоломеева О.М, В.Н. Амирджанова, Е.О., Якушева, и др. Заболеваемость населения России ревматическми болезнями (анализ за 10 лет). // Тер. Архив. 2002, N-5, С. 5-11.
33. Харченко В.П., Нуднов Н.В., Котляров П.М., Гамова Е.В. // Магнитно-резонансная томография (методика исследований). Москва. 2002. С. 29.
34. Цветкова Е.С. Остеоартроз. // В кн.: Руководство по внутренним болезням. Ревматические болезни. М. Медицина. 1997.С. 385-396.
35. Цветкова Е.С., Панасюк Е.Ю. Нестероидные противовоспалительные препараты в терапии остеоартроза // Консилиум. 2003, том 5, N-2. С. 100103.
36. Шастина В.Р., Сысоев В.Ф., Трофимова Т.М. Значение ультразвукового определения подколенных кист. Тер архив. 1988. N-1. С. 104-106.
37. Шастина В.Р. Значение ультразвукового двухмерного сканирования в оценке состояния различных структур коленного сустава у больных ревматоидным артритом. // Дисс. канд. мед. наук. Москва, 1988. С. 174.
38. Эулдеринк Ф. Деструкция сустава при дегенеративных и воспалительных заболеваниях. // Ревматология. 1989. N-2. С. 68-72.
39. Akella S.V., Regatte R.R., Gougoutas A.J.et al. Proteoglycan-induced changes in T1 rho-relaxation of articular cartilage at 4T. // Magn-Reson-Med. 2001 Sep; 46(3): 419-23.
40. Altman R., Arch E., Bloch D. et. al. Development of criteria for the classification and reporting of osteoarthritis: classification of osteoarthritis of the knee. // Arthritis Rhebm. 1986. Vol. 29. P. 1039-1049.
41. Altman R., Howell D., Gottlieb N. New directions in therapy of osteoarthritis. // Semin. Arthritis Rheum. 1987. 17, 2. P. 1-2.
42. Andonopoulos A.P., Yarmenitis S., Sfountouris H., et. al. Baker’s cyst in rheumatoid arthritis: an ultrasonographic study with a high resolution technique. //Clin-Exp-Rheumatol. 1995 Sep-Oct; 13(5): 633-6.
43. Bagge E., Bjelle A., Eden S. Osteoarthrosis in elderly: clinical and radiological finding. //Ann. Rheum. Dis. I991.-Bd. 50. N 8. P. 535-539.
44. Barbuti D., Bergami G., Vecchioli-Scaldazza A. Role of ultra sonography of the knee in the follow-up of juvenile rheumatoid arthritis. // Radiol-Med-Torino. 1997. Jan-Feb; 93 (1-2): 27-32.
45. Barrett A.J. Proteinases in joint disease. // In Kelley W.N. (eds): Texbook of Rheumatology, 1981, 1. P. 195-206.
46. Batalov A., Kuzmanova S., Atanasov A. Ultrasound follow-up study of arthro-scoped patients with gonitis. // Folia-Med-Plovdiv. 1999; 41(2): 63-70.
47. Bergman A.G., Willen H.K., Lindstrand A.L. et al. Osteoarthritis of the knee: correlation of subchondral MR signal abnormalities with histopathologic and radiographic features. // Skeletal Radiol. 1994.Vol. 23. P. 445-448.
48. Bessmel’tsev S.S., Egorova L.V., Kardin V.D. et al. The sonographic characteristics of hemophilic arthropathies. // Vestn-Khir-Im-I-I-Grek. 1996; 155 (3): 45-8.
49. Beuf O., Ghosh S., Newitt D.C. et al. Magnetic resonance imaging in normal and osteoartritic trabecular bone structure in the human knee. // Artritis Rheum 2002 Feb;46(2): 385-93.
50. Blackburn W.D, Chivers S., Bernreuter W. Cartilage imaging in osteoarthritis. // Semin-Arthritis-Rheum. 1996. Feb; 25(4): 273-81.
51. Boegard Т. Radiography and bone scintigraphy in osteoartritis of the knee comparison with MR imaging. //Acta Radiol. 1998. Suppl. 418. P. 7-37.
52. Boegard Т., Rudling O., Petersson I., Jonsson K. Magnetic resonance imaging of the knee in chronic knee pain. A 2-year follow-up. // Osteoartritis-Cartilage. 2001 Jul; 9(5): 473-80.
53. Boyer Т., Daumen-Legre V. Contribution of artroscopy and magnetic resonance imaging to the evaluation of painful knee osteoartritis. // Joint-Bone-Spine. 2000; 67(6): 504-8.
54. Brandt K.D., Thonar E.J. Serum keratan sulphate levels do not reflect cartilage changes of osteoartritis after cruciate ligament transection in the dog. // Arthritis Rheum. 1998. Vol. 31. Suppl. P. 72.
55. Brooks S, Morgan M. Accuracy of clinical diagnosis in knee arthroscopy. // Ann. R. Coll. Surg. Engl. 2002. Jul;84(4): 265-8.
56. Brossman J., Preidler K.W. Daenen B. et al. Imaging of osseous and cartilaginous intraarticular bodies in the knee: comparison of MR imaging and MR arthrography with CT and CT arthrography cadavers. // Radiology. 1996. Vol. 200. P. 509-517.
57. Bui-Mansfield L.T., Yongberg R.A. Intrarticular ganglia of the knee: prevalence, presentation, etiology, and management. // AJR-Am-J-Roentgenol. 1997 Jan; 168 (1): 123-7.
58. Burstein D., Bashir A., Gray M. MRI techniques in early stages of cartilage disease. // Invest-Radiol. 2000 Oct; 35(10): 622-38.
59. Buski В., Lansaman J., Janson X. et al. Arthropathies mecaniques avec grains de riz riches en microcristaux calciques. Quatre cas aves etude ultrastructurale. // Rev. Rhum. Ed. Fr. 1994. Vol. 61. N 6. p. 415-420.
60. Calvo E., Palacios I., Delgado E. et al. High-resolution MRI detects cartilage swelling at the early stages of experimental osteoartritis. // Osteoartritis-Cartilage. 2001 Jul; 9(5): 463-72.
61. Chan W.P., Lang P., Stevens M.P. et al. Osteoarthritis of the knee: Comparison of radiography, CT and MRI to access extent and severity. // Am. J. Roentg. 1991. Vol. 157. P. 799-806.
62. Chylarecki C., Hierholzer G., Tabertshofer H. Ultrasound criteria of fresh rupture of the anterior cruciate ligament. // Unfallchirurgie. 1995 Jun; 21(3): 10917.
63. Chylareci C., Hierholzer G., Klose R. Ultrasound diagnosis of acute rupture of the anterior cruciate ligament. An experimental and clinical study. // Unfallchi-rurg. 1996. Jan; 99(1): 24-30.
64. Cicuttini F., Forbes A., Morris K. et al. Gender differences in knee cartilage volume as measured by magnetic resonance imaging. // Osteoarthritis-Cartilage. 1999 May; 7(3): 265-71.
65. Cicuttini F., Forbes A., Asbeutah A. et al. Comparison and reproducibility of fast and conventional spoiled gradient-echo magnetic resonance sequences in the determination of knee cartilage volume. // J-Orthop-Res. 2000 Jul; 18(4): 580-4.
66. Cicuttini F.M., Wluka A.E., Stuckey S.L. Tibial and femoral cartilage changes in knee osteoartritis. // Ann. Rheum.Dis. 2001.Oct. 60(10): 977-80.
67. Cicuttini F.M., Wluka A.E., Wang Y., et. al. Compartment differences in knee cartilage volume in healthy adults. // J Rheumatol 2002. Mar; 29(3): 554-6.
68. Claessens A., Schoaten J., Ouweland F. Do clinical finding associate with radiographic osteoartritis of the knee. // Ann. Rheum. Diseases. 1990. Vol. 49. N 10. P. 771-774.
69. Claque R.B., Morgan K.A. Absence of autoimmunity to type II collagen in generalised nodal osteoarthritis. //Ann. Rheum. Dis. 1991. 50. P. 769-771.
70. Coari G., Di-Franco M., Jagnocco A. Intra-articular somatostatin 14 reduces synovial thickness in rheumatoid arthritis: an ultrasonographic study. // Int-J-Clin-Pharmacol-Res. 1995; 15(1): 27-32.
71. Cooper С., Ac’Alindon Т., Snow S. et al. Individual risk factors for symptomatic osteoarthritis of the knee // Osteoarthritis and Cartilage, 1993, 1, 1. P. 16-17.
72. Creamer P., Sharif M., George E. et al. Intra-articular hyaluronic acid in osteoarthritis of the knee: an investigation into mechanisms of action. // Os-teoarthritis-Cartilage. 1994. Jun; 2(2): 133-40.
73. Disler D.G., Recht M.P., McCauley T.R. MR imaging of articular cartilage. // Skeletal-Radiol. 2000. Jul; 29 (7): 367-77.
74. Doherty M., Lanion P. Epidemiology of perifiral joint osteoarthritis. // Ann. Rheum. Dis. 1996, 55. P. 585-587.
75. Doppman J.L. // Am. J. Roentgenol. 1965. Vol. 94. C. 646-652.
76. Eckstein F., Winzheimer M., Hohe J. et al. Interindividual variability and correlation among morphological parameters of knee joint cartilage plates: analysis with three-dimensional MR imaging. // Osteoarthritis-Cartilage. 2001. Feb; 9(2): 101-11.
77. Felson D.T., Chaisson C.E., Hill C.L. et. al. The association of bone marrow lesions with pain in knee osteoartritis. // Ann-Intern-Med. 2001. Apr 3; 134 (7): 541-9.
78. Fernandes-Madrid F., Karvonen R.L., Teitge R.A. et al. Synovial thickening detected by MR imaging in osteoarthritis of the knee confirmed by biopsy as synovitis. // Magn-Reson-Imaging. 1995; 13 (2): 177-83.
79. Fife R.S., Brandt K.D. et al. Relationship between arthroscopic evidence of cartilage damage and radiographic evidence of joint space narrowing in early osteoartritis of the knee. // Arthr. Rheum. 1991. Vol. 34. N 4. P. 377-82.
80. Fiocco U., Cozzi L., Rubaltelli L. et al. Long-term sonographic follow-up of rheumatoid and psoriatic proliferative knee joint synovitis. // Br-J-Rheumatol. 1996. Feb; 35 (2): 155-63.
81. Fragonas E., Mlynarik V., Jellus V. et al. Correlation between biochemical composition and magnetic resonance appearance of articular cartilage // Os-teoarthritis-Cartilage. 1998. Jan. Vol .6. N 1. P.24-32.
82. Gaffney K., Cookson J., Blake D. et al. Quantification of rheumatoid synovitis by magnetic resonance imaging. // Arthritis-Rheum. 1995. Nov; 38(11): 16107.
83. Gaulrapp H., Eckstein S. Der Wert der Sonographie nach endoprothetischer Versorgung des Kniegelenks. Value of ultrasound after endoprosthesis implantation of the knee joint. // Z-Orthrop-Ihre-Grenzgeb. 2001 Mar-Apr; 139(2): 127-33.
84. Genovese G., Joyson M., Dixon A. // Ann. Rheum. Dis. 1972. Vol. 31. P. 179182.
85. Giovagnorio F., Martinoly C., Coari G. Power Doppler sonography in knee ar-thritis-a pilot study. // Rheumatol-Int. 2001. Apr; 20(3): 101-4.
86. Grobbelaar N., Bouffard J.A. Sonography in the knee, a pictoral review. // Semin-Ultrasound-CT-MR. 2000. Jun; 21(3): 231-74.
87. Grassi W., Lamanna G., Farina A., Cervini C. Sonographic imaging of normal and osteoarthritic cartilage. // Semin-Arthritis-Rheum. 1999. Jun; 28 (6): 398403.
88. Hamerman D. The biology of osteoarthritis. //N. Engl. J. Med. 1989. Vol. 320 N20. P. 1322-1330.
89. Hammad T.A. Structure modification in knee osteoarthritis: methodology and outcome parameters. // Osteoarthritis-Cartilage. 2001. Jul; 9(5): 488-98.
90. Hardinham T. Control of cartilage matrix senthesis by chondrocytes. // Osteo-tarthritis and Carnilage, 1993, 1, 1, P.79.
91. Hardya P.A., Newmark R., Liu Y.M. et. al. The influence of the resolution and contrast on measuring the articular cartilage volume in magnetic resonance images. // Magn-Reson-Imading. 2000. Oct; 18(8): 965-72.
92. Heinegard D., Saxue T. Macromolecular markers in joint disease. // Semin. Arthritis Rheum. 1990. Vol. 20. N-3, Suppl. 1. P. 27-29.
93. Herasymenko S.T., Huzhevs’kyi I.V., Vovchenko H.Ia., Babko A.N. The ultrasonography of the capsular ligamentous apparatus of the knee joint in the early stages of rheumatoid arthritis. // Lik-Sprava. 1999. Jul. (5): 82-6.
94. Hohe J., Faber S., Stammberger T et. al. A technique for 3D in vivo quantification of proton density and magnetization transfer coefficients of knee joint cartilage. // Osteoarthritis-Cartilage. 2000. Nov; 8(6): 426-33.
95. Kainberger F., Helbich Т., Youssefzadeh S. et. al. Ultrasound diagnosis of the popliteal fossa. //Radiologue.1995. Feb; 35(2): 125-33.
96. Kelsch G., Ulrich C., Bickelhaupt A. Ultrasound imaging of the anterior cruciate ligament. // Unfallchirurg. 1996. Feb; 99 (2): 119-23.
97. Kelley W.N., Harris E.D., Ruddy S. et al. // Texbook of Rheumatology. 1993, P. 1936.
98. Kladny В., Bail H., Swoboda B. et al. Cartilage thickness measurement in magnetic resonance imaging. // Osteoarthritis-Cartilage 1996. Sept. N. 3 , Vol. 4, P. 181-196.
99. Kladny В., Martus P., Schiwy-Bochat K.H. et al. Measurement of cartilage thickness in the human knee-joint by magnetic resonance imaging using a three-dimensional gradient-echo sequence. // Int-Orthop. 1999; 23(5): 264-7.
100. Krappel F., Harland U. Current role of ultrasonography in orthopedics. Results of a nationwide survey. // Z-Orthop-Ihre-Grenzgeb. 1997 Mar-Apr; 135(2): 106-11.
101. Kuzmanova S., Solokov P. Knee synovitis in osteotarthritis-with arthroscopic grading. // Rheum, in Europe. 1997. 26. suppl. 2. P 47.
102. Lang P., Yoshioka H., Steines D., et al. Magnetresonanztomographie (MRT) des Gelenkknorpels. Aktueller Wissensstand und neue Entwicklungen. // Ra-diologe. 2000. Dec; 40 (12): 1141-8.
103. Laughlin J., Dowling В., Mustafa L. et al. // Arth. Rheum. 2002; 46:1519-27.
104. Lohmander L.S. Markers of cartilage matrix metabolism in osteoarthritis. // Osteoartritis and Cartilage. 1991, Vol.1. N 1. P 22.
105. Lohmander L.S. Markers of cartilage matrix metabolism in osteoarthritis.// Osteoartritis and Cartilage, 1993, l.P 22.
106. Lohmander L.S., Lark M.W., Sandy I.D., Grodzinsky A.J. Conseguences and mechanisms of aggrecan degradation in arthritic cartilage. // Rheum, in Europe, 1995, 2, P. 62-65.
107. Manaster B.J., Andrews C.L., Conway W.P. et al. Musculoskeletal radiology: RSNA’94 meeting notes. // Radiology. 1995. Vol. 194. P. 603-606.
108. Marselis S., Daenen B. and Ferrara T.A. Peripheral musculoskeletal ultrasound atlas. // Georg Thime Verlag Stuttgart-New York. 1996. C. 203.
109. McCauley T.R., Disler D.G. Magnetic resonance imaging of articular cartilage of the knee. // J-Am-Acad-Orthrop-Surg. 2001. Jan-Feb; 9(1): 2-8.
110. McCauley T.R., Kornaat P.R., Jee W.H. Central osteophytes in the knee: prevalence and association with cartilage defects on MR imaging. // AJR-Am-J-Roentgenol. 2001. Feb; 176 (2): 359-64.
111. McCauley T.R., Recht M.P., Disler D.G. Clinical imaging of articular cartilage in the knee. // Semin-Musculoskelet-Radiol. 2001. Dec; 5(4): 293-304.
112. Miller T.T., Staron R.B., Koeningsberg T. et al. MR imaging of Baker cysts: association with internal derangement effusion, and degenerative arthropathy. //Radiology. 1996. Oct; 201 (1): 247-50.
113. Moll J.M.N. Osteoarthitis. // In J.M.N. Moll «Rheumatology in clinical practice». 1987, P. 331-346.
114. Moskowits R.W., Kresina T.F. Immunofluorescent analysis of experimental osteoarthritic cartilage and synovium: evidence for selective deposition of immunoglobulin and complement in cartilaginous tissues. // J. Rheumatol. 1986. Vol. 13. N2. P. 391-396.
115. Moskowits R.W. Primary osteoarthritis: epidemiology, clinical aspects, and general management. Amer. J. Med. 1987. Vol. 83, N 5A. P.5-10.
116. Monteforte P., Rovetta G. Sonographic assessment of soft tissue alteration in osteoarthritis of the knee. // Int-J-Tissue-React. 1999; 21(1): 19-23.
117. Montemerani M., Fioravanti A, Scola C. et al. Menopause, oophorectomy, hysterectomy and the risk of the osteoarthritis. // Rheum, in Europe, 1995, 24, suppl.3, P. 321-346.
118. Mnif J., Khannous M., Keskes H. et. al. Ultrasonography in the diagnostic approach of septic arthritis. // Rev-Chir-Orthop-Reparatrice-Appar-Mot. 1997; 83(2): 148-55.
119. Newman J.S., Laing T.J., McCarthy C.J., Adler R.S. Power Doppler sonography of synovitis assessment of therapeutic response preliminary observations. // Radiology. 1996. Feb.; 198(2): 582-4.
120. Niitsu M. Current practise of knee MR imaging in Japan (radiologist’s view). // Semin-Musculoskelet-Radiol.2001. Jun; 5(2): 151-2.
121. Pelletier J.P., Martel-Pelletier J. Cartilage degradation by neutral proteoglyca-nases in experimental osteoarthritis. Suppression by steroids. // Arthr. Rheum. 1985, Vol. 28. N 12. P.1393-1401.
122. Pelletier J.P., McCollum R., DiBattista J. et al. Regulation of human normal and ostheoarthritic chondrocyte interleukin-1 receptor by antirheumatoc drugs. //Arthr. Rheum. 1993. Vol. 36. N 11. P. 1517-1527.
123. Pelletier J.P., Martel-Pelletier // J. Arth. Researeh. 2002; 4(l):13-9.
124. Petersen L.J., Rasmussen O.S. Ultrasonography as a diagnostic method in suspected meniscal lesion of the knee. A prospective single blind study of 52 patients. // Ugeskr-Laeger. 1999 Oct 11; 161(41): 5679-82.
125. Potter H.G., Linklater J.M., Allen A.A. et al. Magnetic resonance imaging of articular cartilage in the knee. An evaluation with use of fast-spin-echo imaging//J-Bone-Joint-Surg-Am. 1998. Sep; 80 (9): 1276-84.
126. Qvistgaad E., Kristoffersen H., Terslev L. et al. Guidance by ultrasound of infra-articular injections in the knee and hip joints. // Osteoarthritis-Cartilage. 2001. Aug; 9(6): 512-7.
127. Radin E.L., Rose R.M. Clin. Orthop. 1986, 213. P. 34-40.
128. Reddy R., Insko E.K., Noyszewski E.A. et al. Sodium MRT of human articular cartilage in vivo. //Magn-Reson-Med. 1998. May; 39(5): 697-701.
129. Richter J., David A., Pape H.G. et al. Diagnosis of acute rupture of the anterior cruciate ligament. Value of ultrasonic in addition to clinical examination. // Unfallchirurg. 1996. Feb; 99(2): 124-9.
130. Riedl S., Tauscher A., Kuhner C. et .al. 3-dimensional sonography in the diagnosis of meniscal lesions. An experimental and clinical study. // Chirurg. 1997. Nov, 68 (11): 1150-5.
131. Riedl S., Tauscher A., Kuhner C. et .al. 3-dimensiional ultrasound in clinical diagnosis of meniscus lesions. // Ultraschall-Med. 1998. Feb; 19(1): 28-33.
132. Russel G. Metalloproteinases, cytokines and matrix degradation in arthritis. // Congress reports, 3/1993.
133. Sattler H., Harlandt U. // Arthrosonography. 1986. Ed. Springer-Verlag.
134. Schacht E. Chondroprotection a perspective. EULAR Bulletin 1986. 4, P. 128-132.
135. Schmidt W.A., Volker L., Zacher J. et .al. Colour Doppler ultrasonography to detect pannus in knee joint synovitis. // Clin-Exp-Rheumatol. 2000. Jul-Aug; 18(4): 439-44.
136. Schwarz W., Hagelstein J., Minholz R. et. al. Manual ultrasound of the knee joint. A general practice method for diagnosis of fresh rupture of the anterior cruciate ligament. // Unfallchirurg. 1997. Apr; 100 (4): 280-5.
137. Seltzer S.E., Finberg H.J., Weissmann B.N. // Invest. Radiol. 1978, 126: 759.
138. Stone K.R., Stoller D., De-Carli A. et. al. The frequency of Baker’s cysts associated with meniscal tears. // Am-J-Sports-Med. 1996. Sep-Oct; 24(5): 6701.
139. Ushakova M.A, Mach E.S., Anan’eva L.P., Pushkova O.V, Mylov N.M. Methods for the instrumental diagnosis and verification of Lyme arthritis. // Ter-Arkh. 1997; 69(5): 15-9.
140. Uhl M., Ihling C., Allmann K.H. et. al. Human articular cartilage: in vitro correlation of MR1 and histologic findings. //Eur-Radiol. 1998; 8 (7): 1123-9.
141. Uhl M., Alllmann K.H., Tauer U. et. al. Comparison of MR sequences in quantifying in vitro cartilage degeneration in osteoarthritis of the knee. // Br-J-Radiol. 1998. Mar; 71 (843): 291-6.
142. Vahlensieck M., Reiser M. MRT des Bewegungsapparats.// Georg Thieme Verlag Stuttgart-New York. 2002. C. 563.
143. Walther M., Harms H., Krenn V. et. al. Correlation of power Doppler sonography with vascularity of the synovial tissue of the knee joint in patients with osteoarthritis and rheumatoid arthritis. // Arthritis-Rheum. 2001. Feb; 44(2): 3318.
144. Waterton J.C., Solloway S., Foster J.E. et. al. Diurnal variation in the femoral articular cartilage of the knee in young adult humans. // Magn-Reson-Med. 2000. Jan; 43(1): 126-32.
145. Waldschmidt J.G., Braunstein E.M., Buckwalter K.A. Magnetic resonance imaging in osteoarthritis. // Rheum-Dis-Clin-North-Am. 1999. May; 25(2): 45165.
146. Winalski C.S., Aliabadi P., Wright R.J. et al. Enhancement of joint fluid with intravenously administered gadopentetate dimeglumine: technique, rationale, and implications. //Radiology. 1993. Vol. 187. P. 179-185.
147. Wluka A.E., Stuckey S., Snaddon J., Cicuttini F.M. The determinants of change in tibial cartilage volume in osteoarthritic knees. // Arthritis Rheum 2002. Aug; 46(8): 2065-72.
148. Yaron M. Do cytokines play a role in the joint destruction in osteoarthritis? // In: Rheumatology, state of the art. 1992. P. 175-177.
149. Yoshioka H., Lang P., Ikeda K. et al. Preliminary trial of three-dimensional water-excitation magnetization transfer contrast MR imaging of articular cartilage. //Nippon-Igaku-Hoshasen-Gakkai-Zasshi. 2001. Sep; 61(10): 545-7.
150. Zohara A. Cohen, Denise M. McCarthy, S. Daniel Kwak et al. Knee cartilage topography, thickness, and contact areas from MRI: in-vitro calibration and in-vivo measurements. // Osteoarthritis-Cartilage. 1999. Jan. N-l.Vol. 7. P. 95109.
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Емелин А.Л.
1, 2
Панков И.О.
3, 2
1 Государственное бюджетное образовательное учреждение высшего профессионального образования «Казанский государственный медицинский университет» Минздрава России
2 ГАУЗ Республиканская клиническая больница Минздрава Республики Татарстан
3 Государственное бюджетное образовательное учреждение дополнительного профессионального образования «Казанская государственная медицинская академия» Минздрава России
Представлены результаты лечения 35 пациентов в возрасте 35–70 лет с тяжелыми деформирующими артрозами коленного сустава II–III стадий после применения инъекционной тромбоцитарной аутоплазмы. Большинство пациентов имели посттравматические артрозы коленного сустава. Все пациенты ранее получали консервативное лечение. У всех пациентов в отдаленном периоде на сроках наблюдения – от 3 месяцев до 3 лет отмечено достоверное улучшение функции коленного сустава, что подтверждалось как субъективной оценкой самих пациентов, которые отмечали значительное снижение болевого синдрома, восстановление функции коленного сустава, уменьшение до полного отсутствия «скованности сустава», а также достоверной динамикой показателей шкалы Womac, что позволяет считать методику «Плазмолифтинг» показанной в комплексном лечении посттравматических артрозов коленного сустава.
коленный сустав
деформирующий артроз коленного сустава
аутоплазма
плазмолифтинг.
1. Алексеева Л.И. Современные представления о диагностике и лечении остеартроза / Л.И. Алексеева // Русский медицинский журнал. Ревматология. – 2000. – № 9. – С. 81.
2. Ахмеров Р.Р. Аутостимуляция регенеративных процессов в челюстно-лицевой хирургии и косметологии. Методическое пособие / Р.Р. Ахмеров, Р.Ф. Зарудий, М.Г. Исаева, А.Ф. Алтыева // Клиника Лафатер. – Москва, 2011. – 22 с.
3. Башкина А.С. Применение обогащенной тромбоцитами плазмы в купировании болевого синдрома большого вертела / А.С. Башкина, Т.С. Широкова, Т.С. Князева, О.М. Паруля [и др.] // Травматология и ортопедия. – 2011. – № 2 (60). – С. 57-61.
4. Кесян Г.А. Оптимизация процессов остеогенеза у травматолого-ортопедических больных с использованием обогащенной тромбоцитами аутоплазмы и биокомпозиционных материалов: Медицинская технология / Г.А. Кесян, Г.Н. Берченко, Р.З. Уразгильдеев. – Москва, 2010. – 18 с.
5. Кириллова И.А. Сочетанное использование остеопластики и обогащенной тромбоцитами плазмы в травматологии и ортопедии / И.А. Кириллова, Н.Г. Фомичев, В.Т. Подорожная // Травматология и ортопедия России. – 2008. – № 3 (49). – С. 63-67.
6. Коваленко В.Н. Остеоартроз. Практическое руководство / В.Н. Коваленко, О.П. Борткевич. – Москва; К.: Морион, 2003. – 448 с.
7. Маланин Д.А. Восстановление поврежденного хряща в коленном суставе / Д.А. Маланин, В.Б. Писарев, В.В. Новочадов. – Волгоград: Волгогр. научное изд-во, 2008. – 346 с.
8. Оганесян О.В. Профилактика развития гонартроза при лечении оскольчатых внутрисуставных переломов проксимального эпиметафиза большеберцовой кости: медицинская технология / О.В. Оганесян, Г.А. Кесян, Р.З. Уразгильдеев. – Москва, 2008. – 19 с.
9. Панков И.О. Чрескостный остеосинтез при лечении переломов области коленного сустава / И.О. Панков, И.В. Рябчиков. – Казань: Отечество, 2011. – 168 с.
10. Сорокин Ю.А. Массивные элиминации плазмы с внутрисуставным введением аутоплазмы в комплексном лечении деформирующего остеоартроза крупных суставов: автореф. дис. … канд. мед. наук. / Ю.А. Сорокин. – Томск, 2001. – 24 с.
Актуальность проблемы. Жизнь человека – это непрерывное движение. Но именно движение представляет для суставов наибольшую опасность, которая заключается в возможности возникновения травм и перегрузок, исходом которых является развитие одного из тяжелых заболеваний опорно-двигательного аппарата – артроза [1,4,6,9].
Травмы – одна из частых причин развития артроза. Даже незначительное повреждение может вызывать нарушение трофики и иннервации сустава, что провоцирует дегенеративные процессы и развитие артроза [6,9].
По данным статистики, наибольшему травматизму подвержены мужчины в возрасте 20–50 лет, женщины в возрасте 30–60 лет. Травмы возникают в быту, на производстве, на улице, в результате дорожно-транспортного происшествия и т.д. Особенно актуальна это проблема для спортсменов и людей, ведущих активный образ жизни [1,6,8].
В структуре травм ведущее место занимают травмы коленного и тазобедренного сустава, реже встречаются травмы голеностопного, локтевого и плечевого суставов.
Наиболее частыми и тяжелыми осложнениями таких травм являются развитие деформирующего артроза и стойких контрактур коленного сустава по причине, в большинстве случаев, неустраненных смещений отломков мыщелков большеберцовой кости. Немаловажное значение имеет тяжесть самой травмы – значительные разрушения опорной суставной поверхности большеберцовой кости могут также стать причиной развития деформирующего артроза коленного сустава [8,9].
Патогенез посттравматического и других вторичных артрозов на конечных стадиях развития схож. Хрящ теряет свою упругость, эластичность, становится шероховатым, в нем появляются трещины с обнажением кости. Отсутствие амортизации при давлении на суставные поверхности костей приводит к их уплотнению (субхондральный остеосклероз) с образованием участков ишемии, склероза, кист. Одновременно с этим, по краям суставных поверхностей эпифизов костей суставной хрящ компенсаторно разрастается с последующим окостенением, с образованием краевых остеофитов и деформацией суставных поверхностей.
Лечение посттравматического артроза – сложный и длительный процесс. Существующие на сегодняшний день способы лечения посттравматического артроза (ПТА) направлены на реализацию одной цели – остановить, или замедлить дегенеративные процессы, происходящие в поврежденном суставе, и включают как консервативные, так и хирургические методы (показаны при тяжелой степени заболевания) [1,5,6,10].
Консервативные методы (медикаментозные: прием НПВС, ангиопротекторов, в/суставное введение ингибиторов протеолиза, препаратов гиалуроновой кислоты и хондропротекторов; немедикаментозные: разгрузка и покой сустава, ЛФК, массаж, физиотерапевтические методы, иглорефлексотерапия, оксигенобаротерапия, бальнеологическое лечение) – наиболее распространенны и направлены на купирование боли, устранение мышечной и артрогенной контрактуры, улучшение функции сустава, коррекцию внутрисуставных нарушений, стимуляцию метаболизма в организме в целом [1, 6-9].
Необходимо отметить, что существующие методы консервативного лечения, посттравматических артрозов, особенно внутрисуставные инъекции хондропротекторов, имеют ряд недостатков, к которым относятся аллергические реакции и дороговизна препаратов, длительный курс лечения, что вызывает дополнительную травму и инфицирование, и, к сожалению, нестойкий результат – около 3-х месяцев.
В качестве нового и безопасного биологического стимулятора, действующего на всю цепочку регенерации и на все ткани одновременно – кость, хрящ, связки, мышцы, применяется тромбоцитарная аутоплазма в виде интра- и периартикулярной инфильтрации тканей. Этот метод получил название «Плазмолифтинг».
Инъекционная форма тромбоцитарной аутоплазмы, название методики – «PlasmoliftingTM», специальные пробирки были разработаны в 2003 году российскими учеными – д.м.н. Ренатом Рашитовичем Ахмеровым и к.м.н. Романом Феликсовичем Зарудий.
Пристальный интерес к аутоплазме связан с содержанием в тромбоцитах многочисленных факторов роста и цитокинов, которые способствуют регенерации поврежденных тканей. Свыше 30 ростовых факторов выявлено в α-гранулах тромбоцитов. Они влияют на процессы восстановления всех тканей сустава одновременно. Наибольшее значение имеют: тромбоцитарный фактор роста (PDGF) – стимулирует хемотаксис, митогенез фибробластов, синтез коллагена; фактор роста эндотелия сосудов (PDEGF) – оказывает стимулирующее действие на эндотелиальные клетки; трансформирующий фактор роста (TGF-ß) последний представляет собой большую группу белков, некоторые из них и морфогенные белки модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты, увеличивают синтез внеклеточного матрикса кости и ингибируют его деградацию и др. факторы роста [2-5;10].
Материалы и методы исследования
Материалы исследования составили 35 пациентов в возрасте 35–70 лет с тяжелыми деформирующими артрозами коленного сустава различной этиологии. Все пациенты ранее проходили курсы консервативной реабилитационной терапии. У подавляющего большинства пациентов сколько-нибудь значительного улучшения не отмечено. При этом относительное большинство пациентов были с посттравматическими деформирующими артрозами. Из всех пациентов больных с посттравматическими артрозами коленного сустава было 24, у 11 пациентов имели место идиопатические артрозы коленного и тазобедренного суставов на фоне остеохондроза поясничного отдела позвоночника. Всем пациентам применено внутрисуставное введение тромбоцитарной аутоплазмы.
Лечение пациентов с применением инъекционной тромбоцитарной аутоплазмы
Инъекционную тромбоцитарную аутоплазму получали путем забора венозной крови пациента (9 мл) в специальные пробирки «PlasmoliftingTM» (рис. 1). Режим центрифугирования составил 3500 об/мин в течение 5 минут на центрифуге «Ева-20» (Германия) (рис. 2). Инъекции аутоплазмы проводились интра- и периартикулярно (рис. 3) по 4,0±0,5 мл в область одного сустава с интервалом 7–10 дней, курс 3–5 процедуры 1–2 раза в год.
На рисунке 1 представлена пробирка Plasmolifting™, содержащая высокоочищенный фракционированный гепарин и биологически инертный гель, обеспечивающие четкое разделение фракций крови по градиенту плотности, сохраняя при этом целебные свойства плазмы. На рисунке 2 – центрифуга для разделения фракций крови «Ева» (Германия).
Рис.1. Пробирка Plasmolifting™ (содержит антикоагулянт)

Рис. 2. Центрифуга для разделения фракций крови «Ева-20» (Германия)
Результаты лечения. Сравнительная оценка эффективности лечения посттравматических артрозов с применением инъекционной тромбоцитарной аутоплазмы производилась у 35 пациентов в возрасте 35–70 лет с диагнозом «посттравматический деформирующий артроз коленного сустава II–III стадии». Критериями оценки проводимой терапии стали показатели «Боль», «Скованность», Функциональная активность» – значения индекса Womac, которые оценивались до лечения, в ближайшем периоде через 1, 3, 6 месяцев, а также в отдаленном периоде на сроках от одного года до трех лет после лечения.
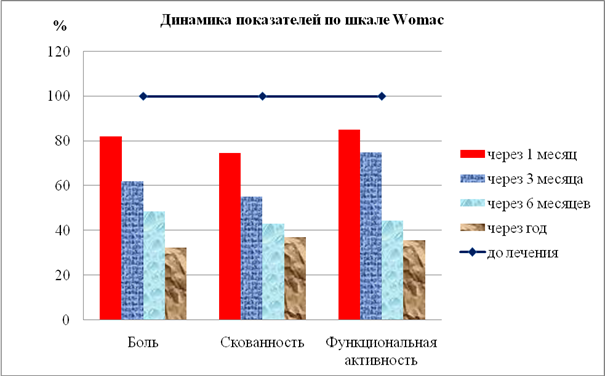
Результаты исследования показали, что применение инъекционной тромбоцитарной аутоплазмы значительно улучшают качество жизни пациентов с деформирующими артрозами, что подтверждалось как субъективной оценкой самих обследуемых, которые отмечали значительное снижение болевого синдрома, восстановление функции сустава, уменьшение и даже полное отсутствие скованности сустава, так и достоверной динамикой показателей шкалы Womac (рис. 3).

Рис. 3. Показатели шкалы Womac в динамике лечения с применением инъекционной тромбоцитарной аутоплазмы (показатели до лечения учитывались как 100 %)
Так интенсивность показателя «Боль» через 1 месяц после лечения снизилась в 1,2 раза, а через 6 месяцев – в 2 раза и достигла наименьших значений к году – показатель составил в среднем 70,12±4,55 условных единиц, что в 3 раза меньше по сравнению с показателями до начала лечения.
При анализе показателя «Скованности» было зарегистрировано достоверное снижение показателя через месяц от начала лечения – на 26, % и более выраженное снижение показателя на сроках 3 и 6 месяцев – соответственно в 1,8 и 2,3 раза и оставался достоверно низким от одного года до трех лет от начала лечения.
Аналогичная динамика, отражающая положительную динамику и, соответственно, подтверждающая эффективность лечения посттравматических артрозов с применением инъекционной тромбоцитарной аутоплазмы, наблюдалась также при оценке показателя «Функциональная активность», который уже на 1 месяце снизился достоверно в 1,2 раза, на третьем в 1,8 раза и продолжал снижаться более выраженно на 6-м месяце – на 60,0 % и через год показатель составил 261,2±9,39 усл. ед., что в 2,8 раза по сравнению со значениями до лечения.
Данные биомеханического исследования опорной, динамической функции нижних конечностей, сенсорного баланса в вертикальной стойке подтвердили клинические данные функциональной реабилитации.
Клинический пример. Пациент Л., 1959 г.р. обратился с жалобами на сильные боли, ограничение функции обоих в коленных суставах. Болен в течение 10 лет, консервативная терапия неэффективна. На основании клинико-рентгенологических данных установлен диагноз: двусторонний деформирующий артроз III стадии. Проведен курс плазмотерапии, который составлял по три внутрисуставных блокады с интервалом 1 неделя. После второй блокады отмечено значительное улучшение, уменьшение интенсивности болей, улучшение функции суставов. Контрольные исследования на сроках 2 месяца и год после лечения также показали значительное улучшение функции коленных суставов и нижних конечностей.
Таким образом, применение инъекционной тромбоцитарной аутоплазмы в комплексной терапии посттравматических артрозов крупных суставов способствует восстановлению функции сустава, уменьшению дегенеративных явлений, что сопровождается увеличением объема движений в суставе, улучшением опорно-двигательной функции нижних конечностей, а также удлинением периода ремиссии заболевания.
Библиографическая ссылка
Емелин А.Л., Панков И.О. СОВРЕМЕННЫЕ ПОДХОДЫ К ЛЕЧЕНИЮ ПОСТТРАВМАТИЧЕСКОГО АРТРОЗА КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. – 2016. – № 3.;
URL: https://science-education.ru/ru/article/view?id=24768 (дата обращения: 14.07.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
